Содержание
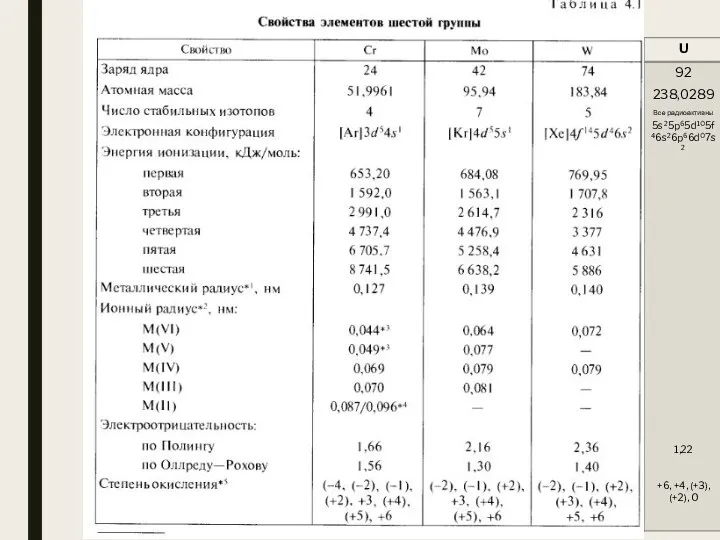
- 4. Важнейшие минералы Cr – хромистый железняк(FeCr2O4), крокоит(PbCrO4), хромовая охра(Cr2O3). Mo – молибденит(MoS2), вульфенит(PbMoO4), повеллит(CaMnO4). Wo -
- 5. Получение Хром встречается в природе в основном в виде хромистого железняка Fe(CrO2)2 из него получают хром
- 6. Затем образовавшийся Na2CrO4 обрабатывают серной кислотой или проводят реакцию в автоклавах под давлением 7-15 атмосфер: Затем
- 7. Получение вольфрама:
- 8. Химические свойства Cr На воздухе пассивируется(!антикоррозийные свойства), не реагирует с амиаком, водой, щелочами, HNO3(к) . !Реагирует
- 9. Химические свойства W и Mo W и Mo химически очень инертны. Это связано с меньшим ОВП
- 10. Химические свойства CrO3(хромовый ангидрид) Разлагается при 450оС Синтез : K2Cr2O7 + 2H2SO4 = 2CrO3 +2KHSO4 +
- 11. Равновесие смещается влево не только в результате изменения pH, но и при добавлении растворимых солей Ba2+,
- 12. Окислительная способность Сr6+ CrO3 поджигает спирт. Смесь 2 объемов K2Cr2O7(нас.) и одного объема H2SO4 – хромпик,
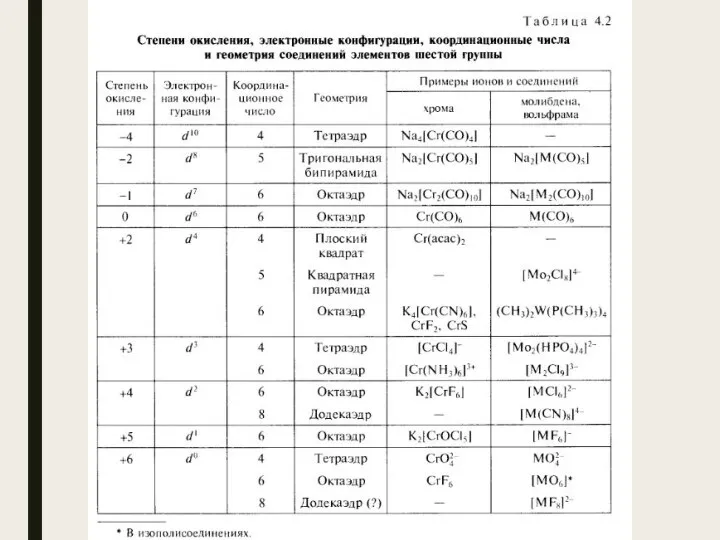
- 13. Cr2O3 !Наиболее устойчивая степень окисления. Амфотерный оксид. Может быть переведён окислителями в Cr+6 , а восстановителями
- 15. Cr(OH)3 Получение – действие на соли растворы солей Cr3+ раствором аммиака или щелочи. Cr(OH)3 + nKOH
- 17. 4CrO + O2 = 2Cr2O3 CrO + H2 = Cr + H2O при 1000°С CrO +
- 18. Cr(OH)2 Желтый, сильный восстановитель в щелочной среде. Очень сложно получить чистым из-за примечи хрома в высших
- 19. Применение Хром — важный компонент во многих легированных сталях (в частности, нержавеющих), а также и в
- 21. Скачать презентацию
















 Отримання кисню. Властивості кисню
Отримання кисню. Властивості кисню Соли. Определение солей
Соли. Определение солей Смещение химического равновесия
Смещение химического равновесия Общая химия
Общая химия Циклоалканы
Циклоалканы Химическая кинетика и катализ
Химическая кинетика и катализ Solutions and solubilities
Solutions and solubilities Искусственные каменные материалы
Искусственные каменные материалы Строение атома
Строение атома Сапалық талдау. Сапалық аналитикалық реакциялар
Сапалық талдау. Сапалық аналитикалық реакциялар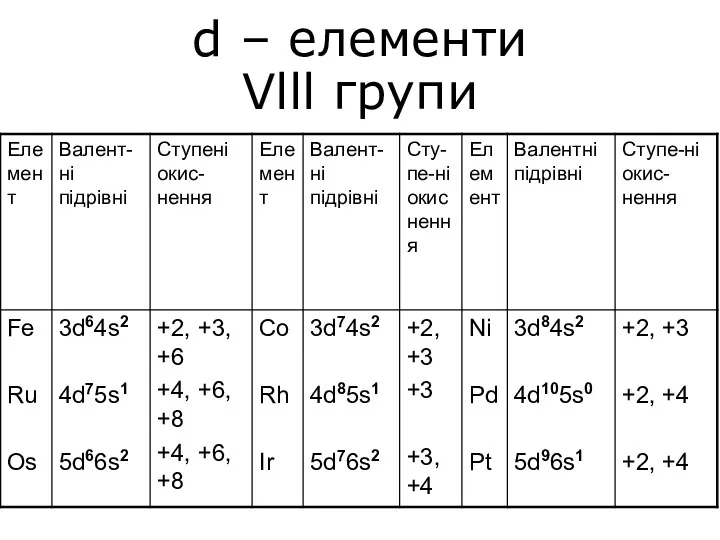 d – елементи Vlll групи
d – елементи Vlll групи Высокомолекулярные соединения (ВМС) или полимеры
Высокомолекулярные соединения (ВМС) или полимеры Реакции ионного обмена. Ионное произведение воды. Водородный показатель. Индикаторы
Реакции ионного обмена. Ионное произведение воды. Водородный показатель. Индикаторы Сущность процесса электролитической диссоциации
Сущность процесса электролитической диссоциации Химические свойства карбоновых кислот
Химические свойства карбоновых кислот Растворы электролитов. Буферные растворы. Лекция 4
Растворы электролитов. Буферные растворы. Лекция 4 Виды коррозии
Виды коррозии Майлардың анықтамасы
Майлардың анықтамасы Алюміній. Загальна характеристика, властивості. Алюміній оксид, алюміній гідроксид, їх амфотерність
Алюміній. Загальна характеристика, властивості. Алюміній оксид, алюміній гідроксид, їх амфотерність Спектральные методы: инфракрасная спектроскопия. Люминесцентный анализ
Спектральные методы: инфракрасная спектроскопия. Люминесцентный анализ Существенные изменения в измерителях ЕГЭ по химии
Существенные изменения в измерителях ЕГЭ по химии Окислительные методы получения органических соединений
Окислительные методы получения органических соединений Амины. Понятие об аминах. Анилин как органическое основание
Амины. Понятие об аминах. Анилин как органическое основание Алкадиены (диены, диеновые углеводороды)
Алкадиены (диены, диеновые углеводороды)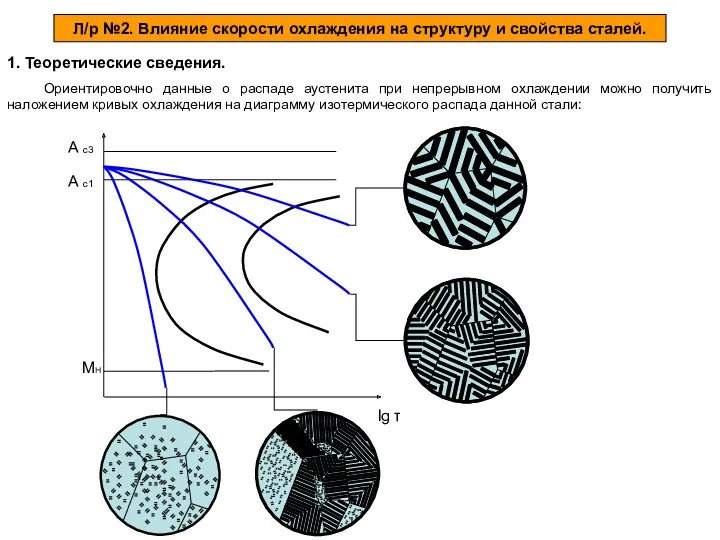 Влияние скорости охлаждения на структуру и свойства сталей
Влияние скорости охлаждения на структуру и свойства сталей Положение в периодической системе Менделеева водорода, лантаноидов, актиноидов и искусственно полученных элементов
Положение в периодической системе Менделеева водорода, лантаноидов, актиноидов и искусственно полученных элементов Алкины
Алкины Алкены. Этиленовые углеводороды, олефины
Алкены. Этиленовые углеводороды, олефины