Содержание
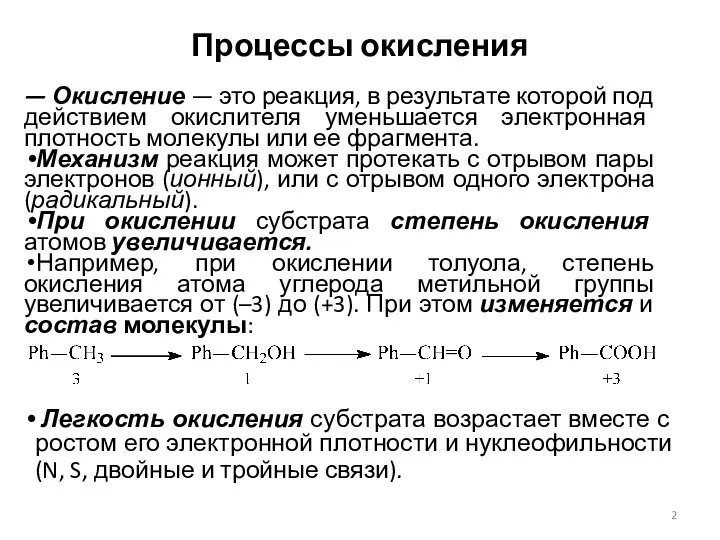
- 2. Процессы окисления — Окисление — это реакция, в результате которой под действием окислителя уменьшается электронная плотность
- 3. Окислители В качестве окислителей используются сильные электрофилы: простые вещества — кислород, озон, сера, галогены; оксиды элементов
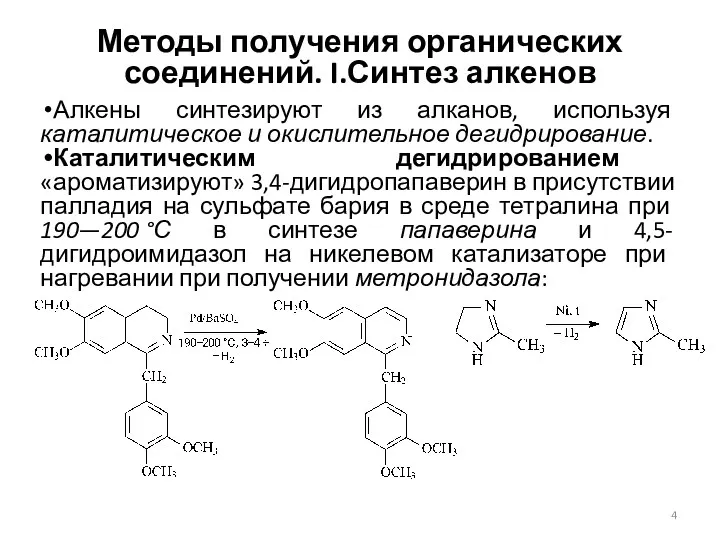
- 4. Методы получения органических соединений. I.Синтез алкенов Алкены синтезируют из алканов, используя каталитическое и окислительное дегидрирование. Каталитическим
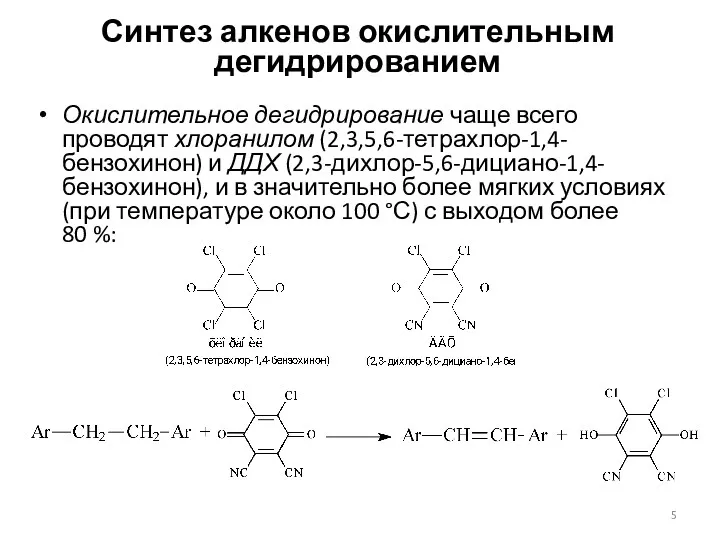
- 5. Синтез алкенов окислительным дегидрированием Окислительное дегидрирование чаще всего проводят хлоранилом (2,3,5,6-тетрахлор-1,4-бензохинон) и ДДХ (2,3-дихлор-5,6-дициано-1,4-бензохинон), и в
- 6. II.Окислительные методы получения альдегидов 1.Альдегиды, как правило, окисляются легче, чем субстрат, а также полимеризуются и конденсируются,
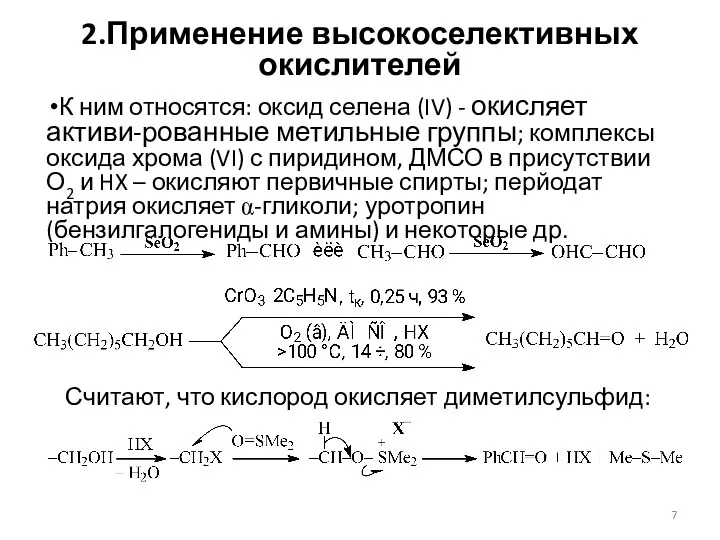
- 7. 2.Применение высокоселективных окислителей К ним относятся: оксид селена (IV) - окисляет активи-рованные метильные группы; комплексы оксида
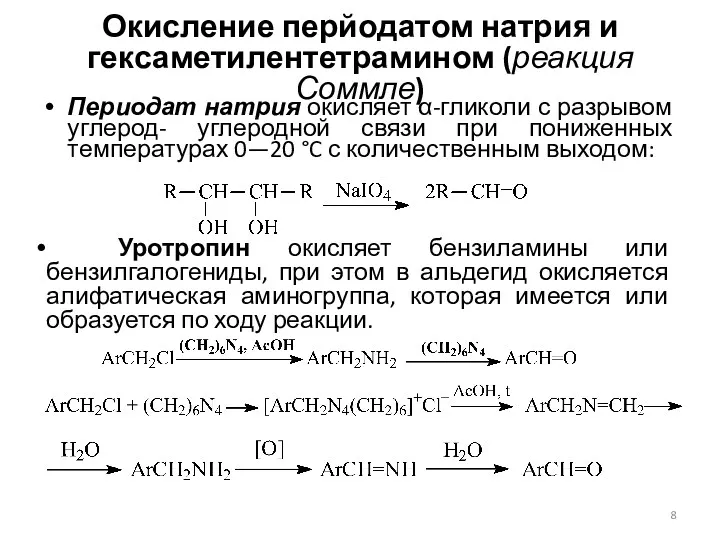
- 8. Окисление перйодатом натрия и гексаметилентетрамином (реакция Соммле) Периодат натрия окисляет α-гликоли с разрывом углерод- углеродной связи
- 9. 3.Применение кислорода и высокоселективных катализаторов Неселективное окисление толуола и его производных воздухом в жидкой и газовой
- 10. 4.Применение специальных технологических приемов При использовании обычных окислителей необходимо применять специальные технологические приемы (удаление альдегидов из
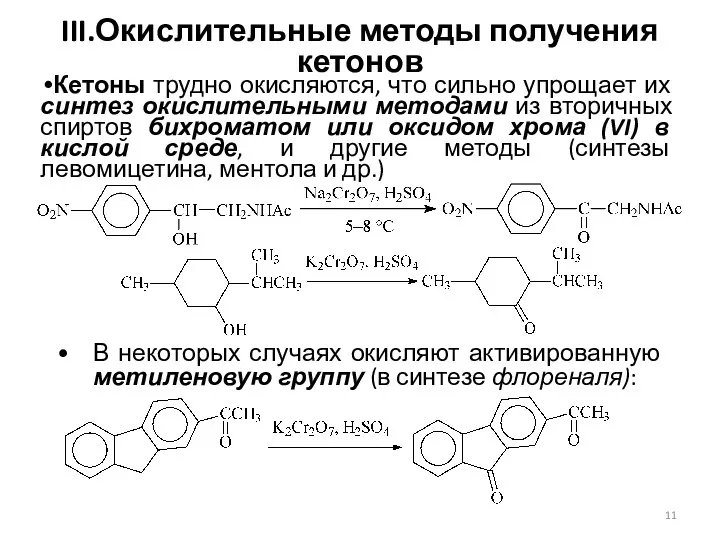
- 11. III.Окислительные методы получения кетонов Кетоны трудно окисляются, что сильно упрощает их синтез окислительными методами из вторичных
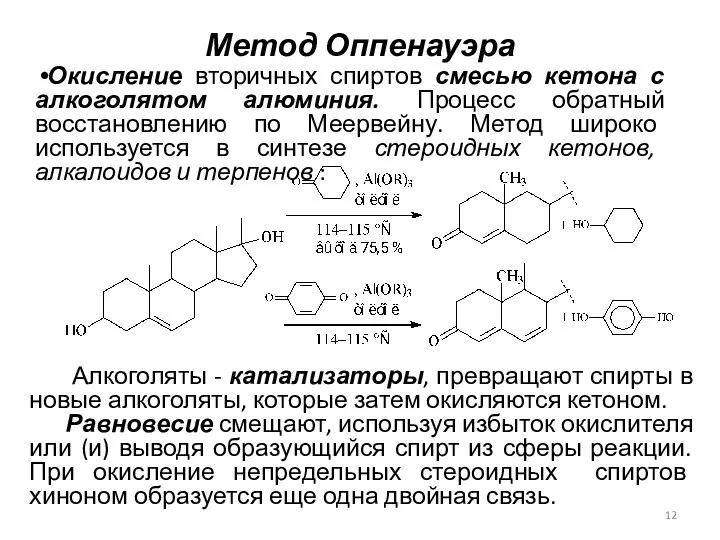
- 12. Метод Оппенауэра Окисление вторичных спиртов смесью кетона с алкоголятом алюминия. Процесс обратный восстановлению по Меервейну. Метод
- 13. Окисление бензоина в бензил Окисление бензоина в уксусной кислоте 71 % азотной кислотой при температуре около
- 14. IV.Каталитическое окисление парафинов кислородом воздуха в карбоновые кислоты Неразветвленные алканы - трудноокисляемые соединениями. Обычные окислители не
- 15. V.Окисление активированных групп в карбоновые кислоты Активированные алкильные группы (связанные с карбонильной группой, ароматическим кольцом и
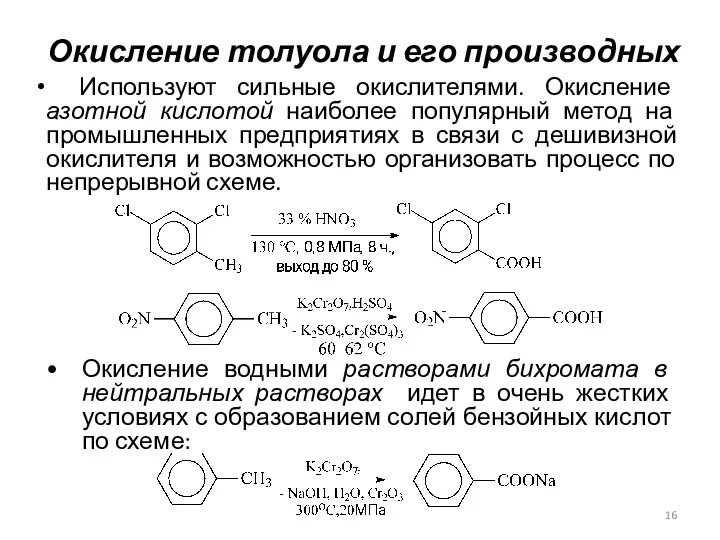
- 16. Окисление толуола и его производных Используют сильные окислителями. Окисление азотной кислотой наиболее популярный метод на промышленных
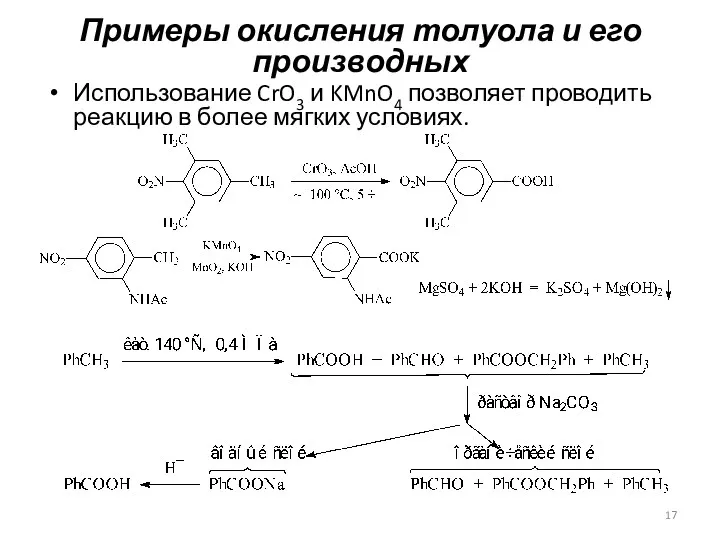
- 17. Примеры окисления толуола и его производных Использование CrO3 и KMnO4 позволяет проводить реакцию в более мягких
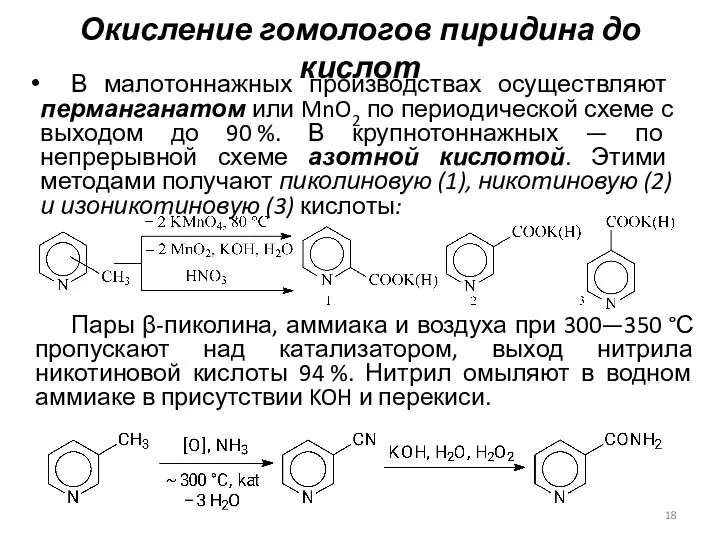
- 18. Окисление гомологов пиридина до кислот В малотоннажных производствах осуществляют перманганатом или MnO2 по периодической схеме с
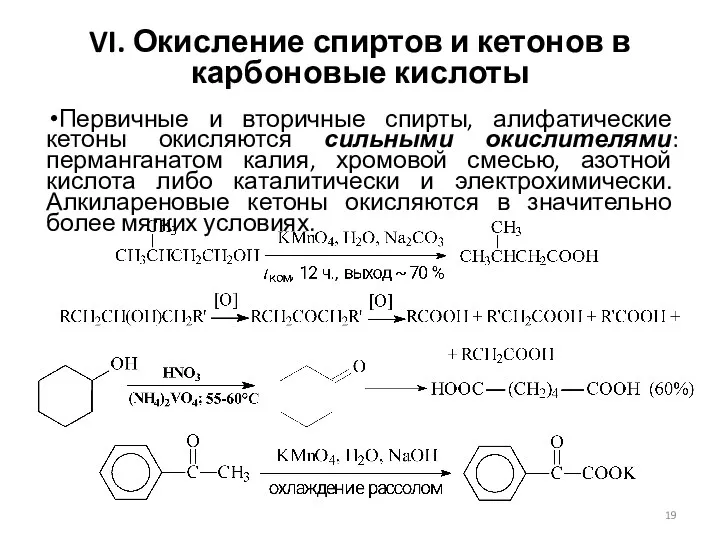
- 19. VI. Окисление спиртов и кетонов в карбоновые кислоты Первичные и вторичные спирты, алифатические кетоны окисляются сильными
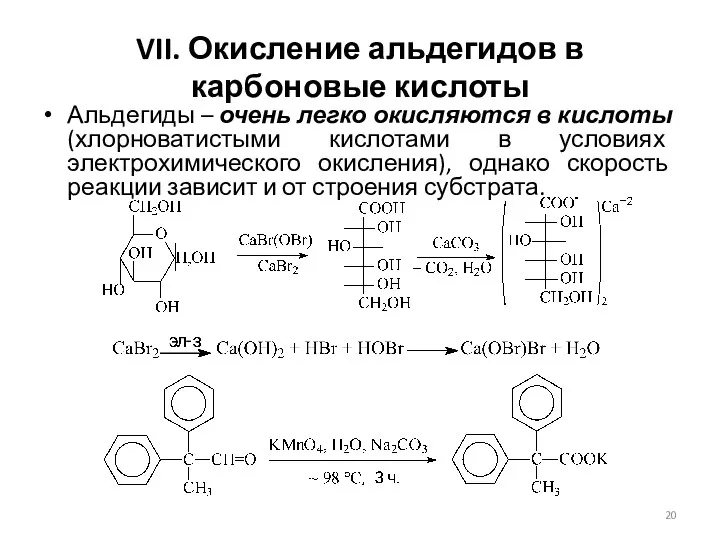
- 20. VII. Окисление альдегидов в карбоновые кислоты Альдегиды – очень легко окисляются в кислоты (хлорноватистыми кислотами в
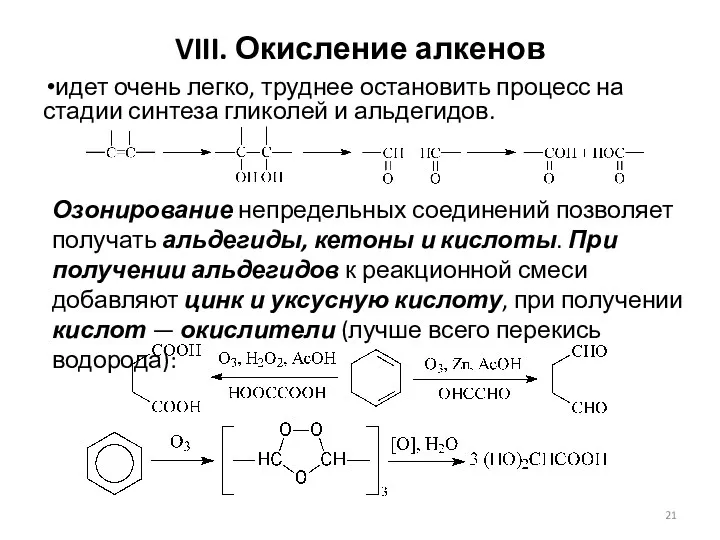
- 21. VIII. Окисление алкенов идет очень легко, труднее остановить процесс на стадии синтеза гликолей и альдегидов. Озонирование
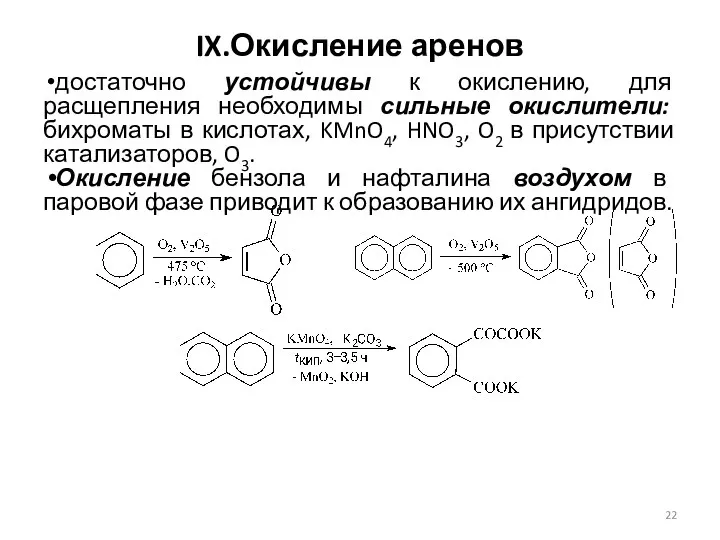
- 22. IX.Окисление аренов достаточно устойчивы к окислению, для расщепления необходимы сильные окислители: бихроматы в кислотах, KMnO4, HNO3,
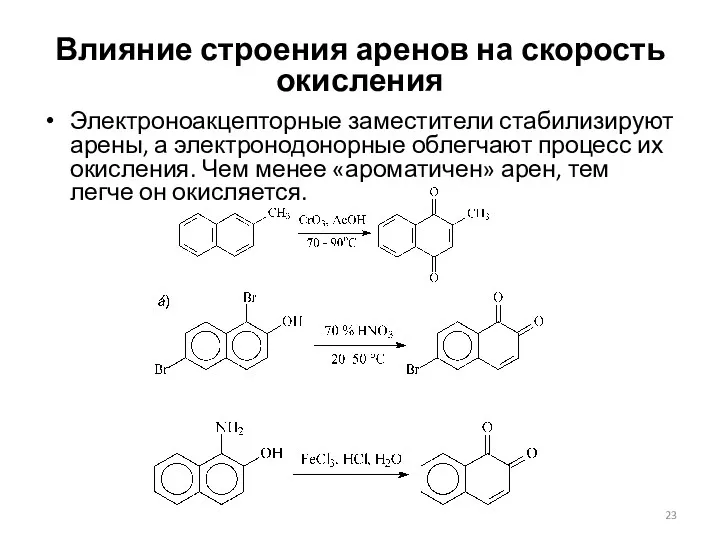
- 23. Влияние строения аренов на скорость окисления Электроноакцепторные заместители стабилизируют арены, а электронодонорные облегчают процесс их окисления.
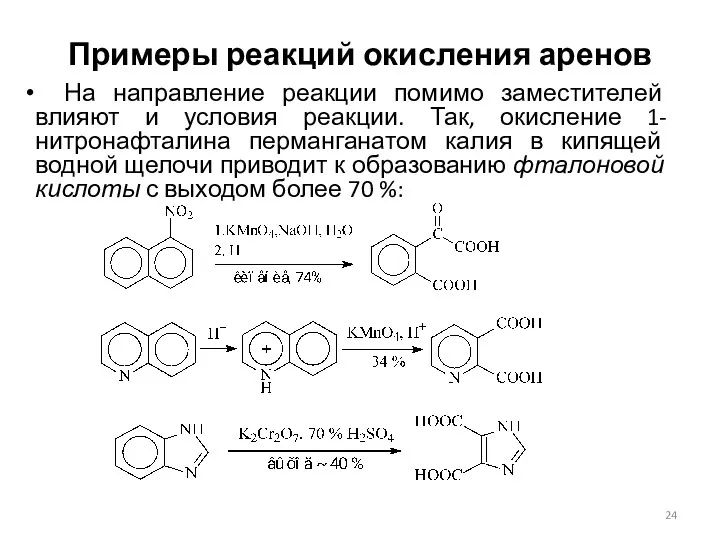
- 24. Примеры реакций окисления аренов На направление реакции помимо заместителей влияют и условия реакции. Так, окисление 1-нитронафталина
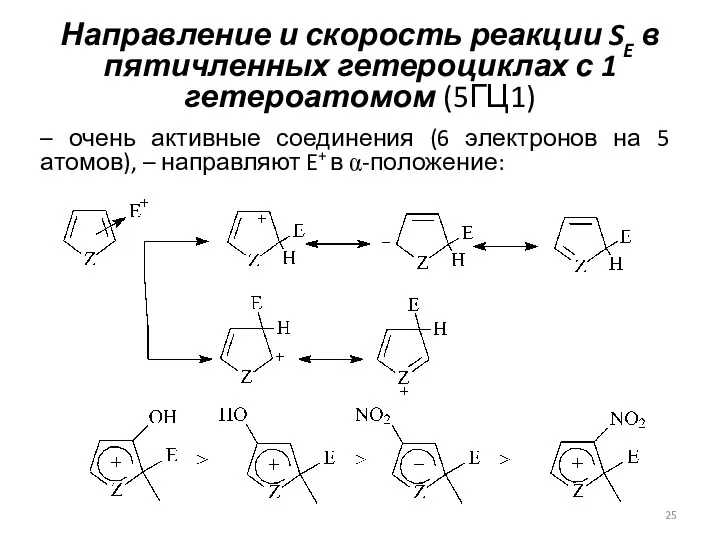
- 25. Направление и скорость реакции SE в пятичленных гетероциклах с 1 гетероатомом (5ГЦ1) – очень активные соединения
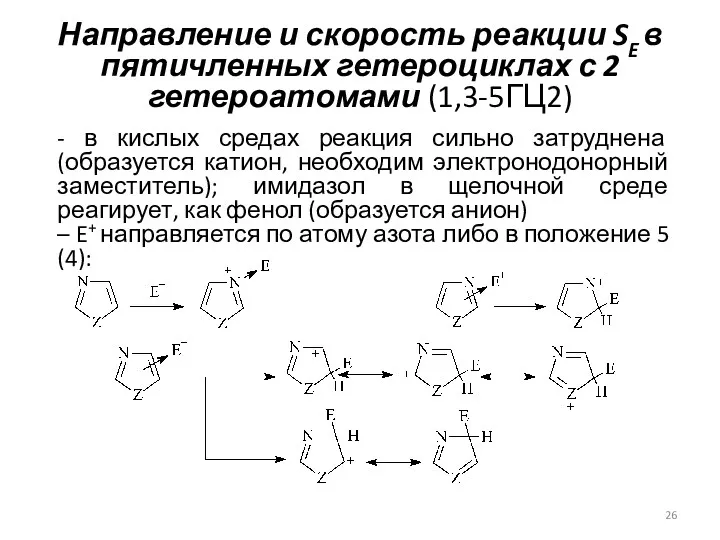
- 26. Направление и скорость реакции SE в пятичленных гетероциклах с 2 гетероатомами (1,3-5ГЦ2) - в кислых средах
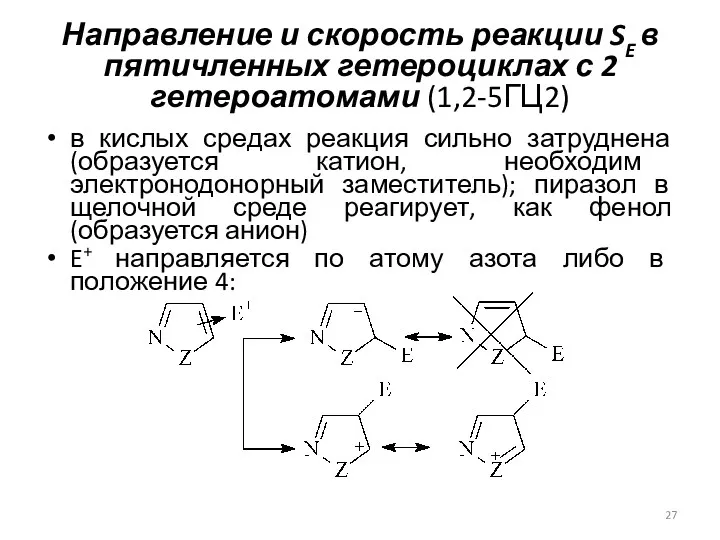
- 27. Направление и скорость реакции SE в пятичленных гетероциклах с 2 гетероатомами (1,2-5ГЦ2) в кислых средах реакция
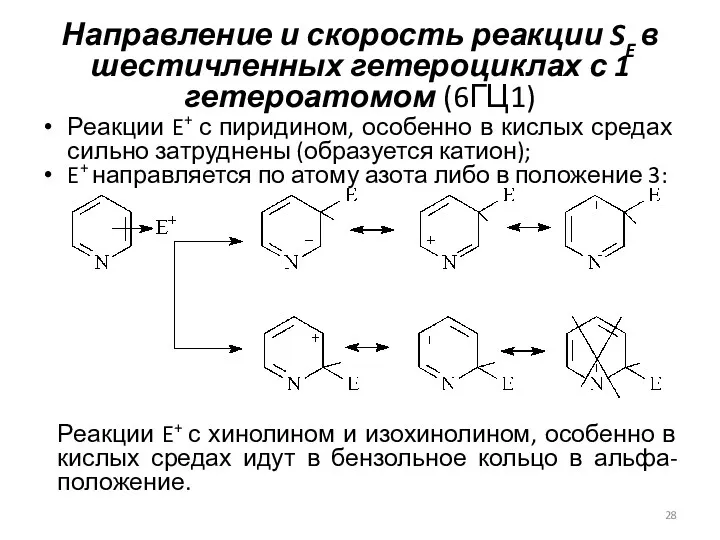
- 28. Направление и скорость реакции SE в шестичленных гетероциклах с 1 гетероатомом (6ГЦ1) Реакции E+ с пиридином,
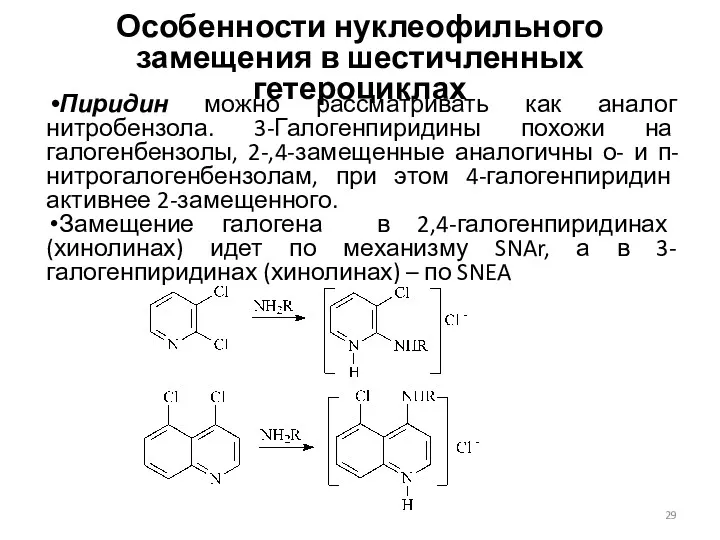
- 29. Особенности нуклеофильного замещения в шестичленных гетероциклах Пиридин можно рассматривать как аналог нитробензола. 3-Галогенпиридины похожи на галогенбензолы,
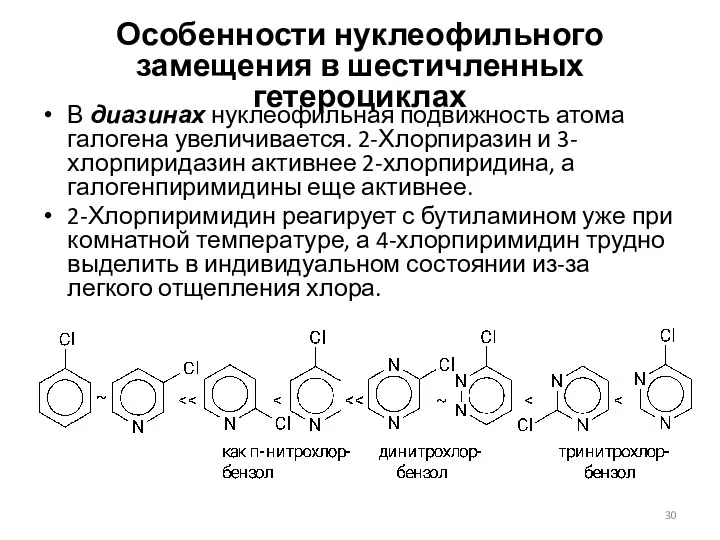
- 30. Особенности нуклеофильного замещения в шестичленных гетероциклах В диазинах нуклеофильная подвижность атома галогена увеличивается. 2-Хлорпиразин и 3-хлорпиридазин
- 32. Скачать презентацию







 Максимально очищенные фитопрепараты. Технология и стандартизация
Максимально очищенные фитопрепараты. Технология и стандартизация Лекарственные средства, производные пиридина и пиперазина
Лекарственные средства, производные пиридина и пиперазина Растворы. Классификация, способы выражения концентрации, свойства растворов
Растворы. Классификация, способы выражения концентрации, свойства растворов Heavy metals
Heavy metals Химические методы выявления потожировых следов
Химические методы выявления потожировых следов Искусственные и трансурановые элементы
Искусственные и трансурановые элементы Карбонові кислоти
Карбонові кислоти Перманганат калия
Перманганат калия АЛКАНЫ Строение молекулы метана.
АЛКАНЫ Строение молекулы метана. Вещественный состав магматических горных пород и петрохимические пересчеты
Вещественный состав магматических горных пород и петрохимические пересчеты Химические свойства основных классов неорганических соединений
Химические свойства основных классов неорганических соединений Периодический закон Менделеева
Периодический закон Менделеева Кислород
Кислород Непредельные углеводороды. Алкины
Непредельные углеводороды. Алкины Аллотропия
Аллотропия Химическая промышленность России входит в авангардную тройку
Химическая промышленность России входит в авангардную тройку Вещества и физические тела
Вещества и физические тела Химическая технология природных энергоносителей и углеродных материалов
Химическая технология природных энергоносителей и углеродных материалов Алканы.Определение. Общая формула класса углеводородов
Алканы.Определение. Общая формула класса углеводородов Уникальная соль (для дошколников)
Уникальная соль (для дошколников) Химические свойства толуола
Химические свойства толуола Окислительно-восстановительные реакции. Основные положения электронной теории ОВР
Окислительно-восстановительные реакции. Основные положения электронной теории ОВР Перегонка с водяным паром
Перегонка с водяным паром Вода
Вода Припекание взаимно растворимых твердых тел
Припекание взаимно растворимых твердых тел 5.Алкины
5.Алкины Циклические углеводороды
Циклические углеводороды Химический элемент водород
Химический элемент водород