Содержание
- 2. План лекции Основные положения электронной теории ОВР Типы ОВР Важнейшие окислители и восстановители Составление уравнений ОВР.
- 3. Окислительно-восстановительные реакции (ОВР ) Многие природные (круговорот элементов) и производственные процессы (получение металлов, синтез различных веществ),
- 4. Реакции ионного обмена протекают без изменения степени окисления элементов в случае образования малодиссоциирующего вещества, газа, осадка,
- 5. Типы ОВР Если элементы, изменяющие степень окисления, находятся в составе разных молекул, то такие окислительно-восстановительные реакции
- 6. Важнейшие окислители и восстановители Атом элемента в своей положительной высшей степени окисления проявляет только окислительные свойства
- 7. Важнейшие окислители. 1. Все неметаллы по отношению к простым веществам (к металлам, к неметаллам с меньшей
- 8. 3. Кислородсодержащие соли элементов в высокой степени окисления, например:
- 9. 4. Катион водорода при взаимодействии с активными металлами (стоящими в ряду напряжений от магния до водорода),
- 10. Из окислителей практическую значимость имеют перманганат калия и дихромат калия. На их использовании основаны такие методы
- 11. Важнейшие восстановители. 1. Простые вещества – металлы обладают только восстановительными свойствами: Meo(Na, K, Mg, Al, Zn,
- 12. 2. Простые вещества элементов IV- VII групп (неметаллы) в большей степени проявляют окислительные свойства. За исключением
- 13. 4. Гидриды металлов I А и II А групп: 5. Катионы металлов в низшей положительной степени
- 14. Окислительно-восстановительная двойственность Вещества, в которых атомы элементов находятся в промежуточной степени окисления, в зависимости от условий
- 15. Степень окисления Под степенью окисления понимают условный заряд на атоме в молекуле, вычисленный исходя из предложения,
- 16. При определении степени окисления элементов пользуются следующими правилами: сумма степеней окисления элементов, составляющих молекулу равна нулю,
- 17. Используя вышеуказанные правила, степень окисления элементов определяют следующим образом: +1 + х + 4(−2) = 0;
- 18. Составление уравнений окислительно-восстановительных реакций Применяются два метода составления уравнений ОВР: метод электронного баланса метод полуреакций (ионно-электронный
- 19. Чтобы поставить коэффициенты в уравнении реакции, необходимо найти кратное для чисел, показывающих повышение и понижение степеней
- 20. Найденные коэффициенты подставляют в уравнение реакции: Для проверки правильности подобранных коэффициентов подсчитывают баланс кислорода. Далее подбирают
- 21. Ионно-электронный метод Особенности метода полуреакций заключаются в следующем: Метод учитывает реальное существование ионов в водных растворах,
- 22. Атомы кислорода должны быть перераспределены в системе так, чтобы образовалась вода (наименее диссоциированное соединение), для этого
- 23. Ионно-электронный метод основан на составлении частных уравнений окисления и восстановления ионов (молекул) с последующим суммированием их
- 24. Далее устанавливают баланс атомов и зарядов в общем уравнении: Если в качестве среды взята серная кислота,
- 25. с остальными металлами и некоторыми неметаллами (S, P, C) восстанавливается до NO2 Разбавленная азотная кислота восстанавливается
- 26. Cильно разбавленная азотная кислота Активные металлы (Mg, Al, Zn) сильно разбавленную азотную кислоту восстанавливают до аммиака
- 27. Разбавленная серная кислота Разбавленная серная кислота проявляет окислительные свойства по отношению к активным металлам (стоящим в
- 28. Концентрированная серная кислота Окислительные свойства концентрированной серной кислоты определяются сульфат-ионом. Продуктами его восстановления в зависимости от
- 29. Концентрированная серная кислота с остальными металлами (за исключением Au, Pt, Pd, Rh, Os, Ir, Ru) и
- 30. ОВР в заданиях билетов ЕГЭ Степень окисления химических элементов (код 2.3), окислительно-восстановительные реакции (код 3.7) –
- 31. На базовом и повышенном уровнях проверяются умения определять степень окисления химических элементов по формулам их соединений,
- 32. Установите соответствие между химической формулой соединения и степенью окисления фосфора в нем. ХИМИЧЕСКАЯ ФОРМУЛА СТЕПЕНЬ ОКИСЛЕНИЯ
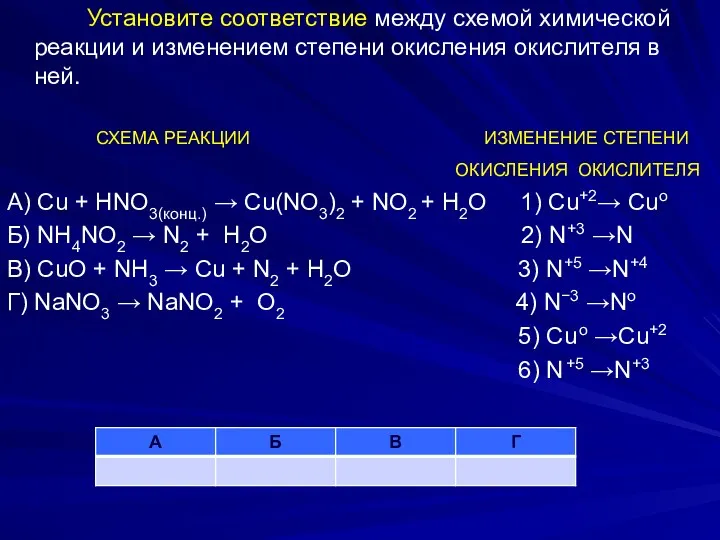
- 33. Установите соответствие между схемой химической реакции и изменением степени окисления окислителя в ней. СХЕМА РЕАКЦИИ ИЗМЕНЕНИЕ
- 34. Установите соответствие между схемой химической реакции и веществом - окислителем в каждой из них. СХЕМА РЕАКЦИИ
- 36. Скачать презентацию
































 Химическое равновесие. Принцип Ле Шателье
Химическое равновесие. Принцип Ле Шателье Соединения галогенов
Соединения галогенов Аминокислоты. Пептиды. Хроматографические методы исследования
Аминокислоты. Пептиды. Хроматографические методы исследования Химическая связь
Химическая связь Массовая доля вещества в растворе
Массовая доля вещества в растворе Визначення іонів лужних і лужноземельних іонів у природних водах
Визначення іонів лужних і лужноземельних іонів у природних водах Уникальная соль (для дошколников)
Уникальная соль (для дошколников) Пищевые добавки
Пищевые добавки Коллигативные свойства растворов
Коллигативные свойства растворов Основы термической и химико-термической обработки стали. Теория и технология термической обработки стали. Лекция 3. Тема 7
Основы термической и химико-термической обработки стали. Теория и технология термической обработки стали. Лекция 3. Тема 7 Литий. Физические свойства лития
Литий. Физические свойства лития Типы заданий. ЕГЭ №32
Типы заданий. ЕГЭ №32 20230419_izomery
20230419_izomery Растворы и растворители
Растворы и растворители Фосфор и его соединения
Фосфор и его соединения Общая характеристика неметаллов
Общая характеристика неметаллов Простые вещества. Игра Счастливый случай
Простые вещества. Игра Счастливый случай Элемент, имеющий относительную атомную массу
Элемент, имеющий относительную атомную массу Введение в аналитическую химию. Введение в качественный анализ
Введение в аналитическую химию. Введение в качественный анализ Алканы. Гомологи
Алканы. Гомологи Методы разделения и исследования состава нефти и газа
Методы разделения и исследования состава нефти и газа Формальная кинетика. Предмет химической кинетики
Формальная кинетика. Предмет химической кинетики Хром. Элемент под № 24
Хром. Элемент под № 24 Аммиак. Состав вещества
Аммиак. Состав вещества Галогены. Фтор, хлор, бром, йод, астат
Галогены. Фтор, хлор, бром, йод, астат Породообразующие минералы
Породообразующие минералы Особенности строения, реакционной способности и методы синтеза гидроксилсодержащих соединений
Особенности строения, реакционной способности и методы синтеза гидроксилсодержащих соединений Взрывоопасные грузы
Взрывоопасные грузы