Содержание
- 2. Основные темы 1. Совместный гидролиз 2. Амфотерность 3. Разложение нитратов 5. Получение простых веществ 4. Иодид-ион
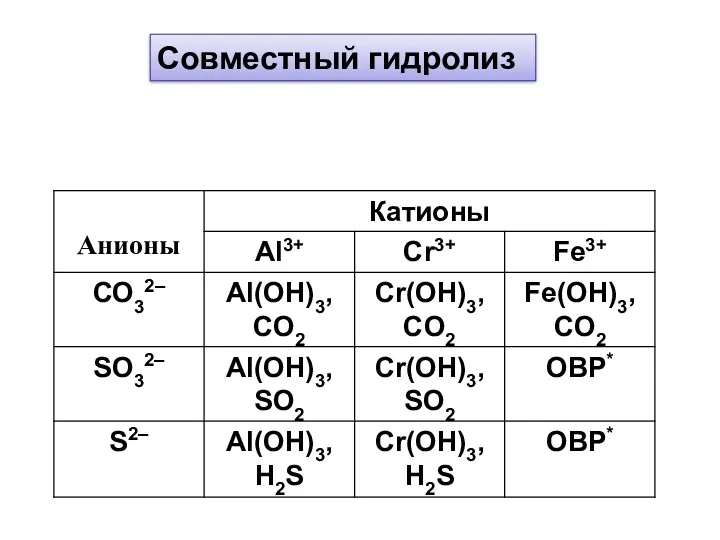
- 3. Совместный гидролиз
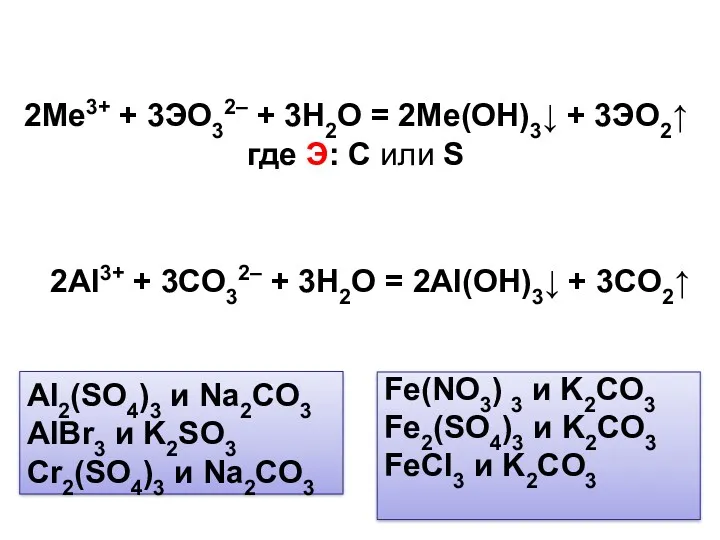
- 4. 2Al3+ + 3CO32– + 3H2O = 2Al(OH)3↓ + 3CO2↑ 2Me3+ + 3ЭO32– + 3H2O = 2Me(OH)3↓
- 5. К раствору сульфата алюминия добавили сульфит натрия, выделившийся газ пропустили через раствор сульфата железа(III). Выделенную из
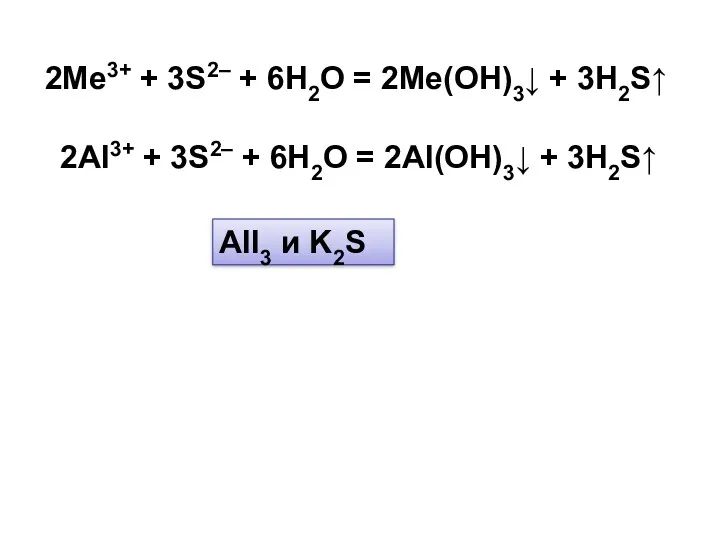
- 6. 2Me3+ + 3S2– + 6H2O = 2Me(OH)3↓ + 3H2S↑ AlI3 и K2S 2Al3+ + 3S2– +
- 7. Амфотерность Таблица 10.1. Комплексообразование в расплавах
- 8. Таблица 10.2. Комплексообразование в растворах
- 9. Гидроксокомплексы разрушаются под действием 1. Сильных кислот 2. Слабых кислот (H2S, CO2, SO2); образуются кислые соли
- 10. Цинк растворили в концентрированном растворе гидроксида калия. Через полученный раствор пропустили продукт горения сероводорода в избытке
- 11. Алюминат натрия растворили в воде, осадок отделили фильтрованием. Фильтрат обработали гидрокарбонатом натрия, а затем – нитратом
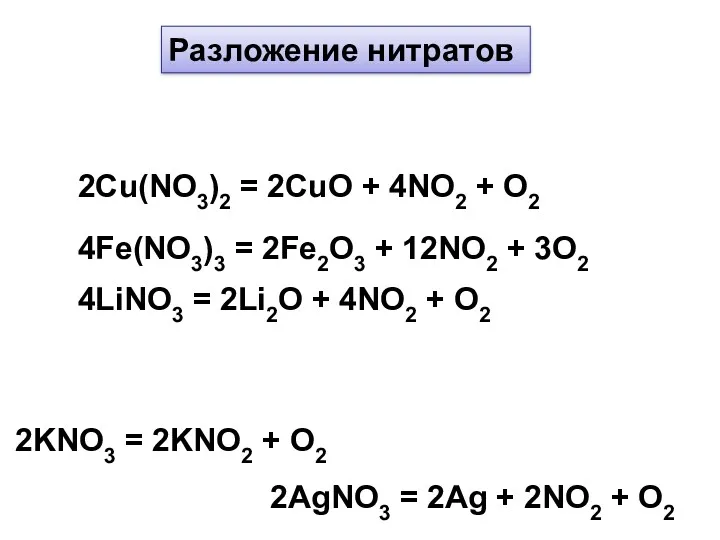
- 12. Разложение нитратов 2Cu(NO3)2 = 2CuO + 4NO2 + O2 4Fe(NO3)3 = 2Fe2O3 + 12NO2 + 3O2
- 13. Нитрат железа(II) прокалили, образовавшееся твердое вещество растворили в иодоводородной кислоте. Образовавшуюся соль выделили из полученного раствора,
- 14. Диоксид марганца растворили в конц. соляной кислоте. После удаления газа раствор обработали нитратом серебра. Осадок отделили
- 15. Получение простых веществ Cпособ получения фосфора: Ca3(PO4)2 + 5C + 3SiO2 = 2P + 5CO +
- 16. Фосфат кальция прокалили без доступа воздуха с песком и углем. Образовавшийся газ пропустили совместно с хлором
- 17. Силицид кальция поместили в воду. Образовавшийся при этом газ прореагировал с кислородом. Полученное твёрдое вещество сплавили
- 18. Ковалентный гидролиз 1. Карбидов CaC2, Al4C3 2. Силицидов Mg2Si 3. Нитридов Ca3N2, Li3N 4. Фосфидов Ca3P2,
- 19. Силицид магния растворили в разбавленной соляной кислоте, выделившийся газ сожгли, твердый продукт реакции нагрели при высокой
- 20. Иодид-ион – восстановитель 2Cu(OH)2 + 4HI = 2CuI + I2 + 4H2O 2Fe(OH)3 + 6HI =
- 22. Скачать презентацию















 Основи. Склад, назви, класифікація, використання
Основи. Склад, назви, класифікація, використання Насичені одноатомні спирти, їх фізичні та хімічні властивості. Одержання етанолу
Насичені одноатомні спирти, їх фізичні та хімічні властивості. Одержання етанолу Тепловой эффект химической реакции
Тепловой эффект химической реакции Переходные элементы
Переходные элементы Природный и попутный нефтяной газы
Природный и попутный нефтяной газы Химическая связь
Химическая связь Тепловой эффект химической реакции, термохимические уравнения, экзо- и эндотермические реакции
Тепловой эффект химической реакции, термохимические уравнения, экзо- и эндотермические реакции Хімічні властивості кислот
Хімічні властивості кислот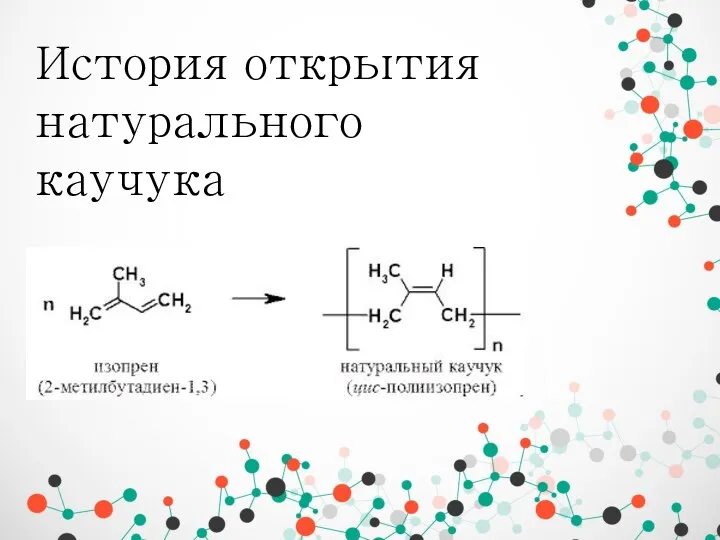 История открытия натурального каучука
История открытия натурального каучука Минералогический состав почв
Минералогический состав почв Простые вещества. Металлы и неметаллы
Простые вещества. Металлы и неметаллы Жорсткість води і методи її усунення. 11 клас
Жорсткість води і методи її усунення. 11 клас Химический элемент радий
Химический элемент радий Ask the right question to find the best answer
Ask the right question to find the best answer Количественная характеристика растворов, растворение, растворимость
Количественная характеристика растворов, растворение, растворимость Водород
Водород Силикатная промышленность. 9 класс
Силикатная промышленность. 9 класс Природные (натуральные) полимеры. Композиционные материалы
Природные (натуральные) полимеры. Композиционные материалы Серная кислота
Серная кислота Окислительно-восстановительные реакции
Окислительно-восстановительные реакции Цинк(ZN), хром(Cr). Зовнішній вигляд простої речовини
Цинк(ZN), хром(Cr). Зовнішній вигляд простої речовини Кислород. Электронное строение и свойства
Кислород. Электронное строение и свойства Реакции солей в растворе. Гидролиз солей. Водородный показатель рН
Реакции солей в растворе. Гидролиз солей. Водородный показатель рН Щелочи
Щелочи Общая геохимия. Периодический закон Менделеева. Строение электронных оболочек. Геохимические классификации элементов
Общая геохимия. Периодический закон Менделеева. Строение электронных оболочек. Геохимические классификации элементов Кремний и его соединения для 11 класса
Кремний и его соединения для 11 класса Перманганат калия
Перманганат калия Химическая промышленность Донецкой области
Химическая промышленность Донецкой области