Содержание
- 2. Растворы Растворы представляют собой гомогенные, или однородные, системы переменного состава, которые содержат два или несколько компонентов.
- 3. Растворы Раствор = Растворитель + Растворённое вещество Растворы Водные Неводные Водные растворы – это растворы, в
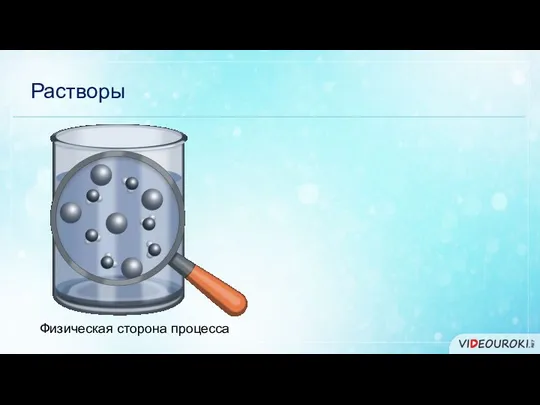
- 4. Растворы Физическая сторона процесса
- 5. Растворы Физическая сторона процесса Химическая сторона процесса
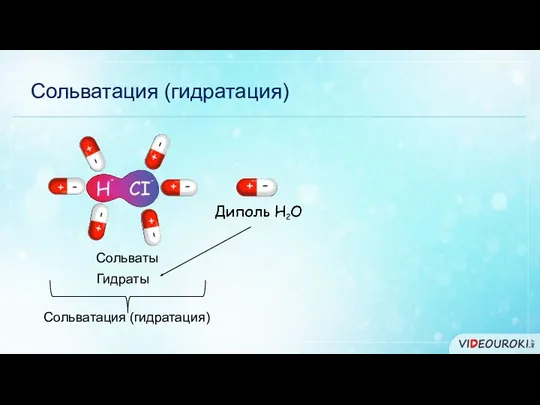
- 6. Сольватация (гидратация) Сольваты Гидраты Сольватация (гидратация)
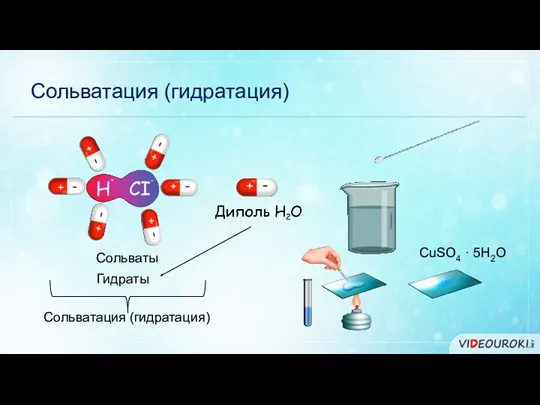
- 7. Сольватация (гидратация) Сольваты Гидраты Сольватация (гидратация) CuSO4 · 5H2O
- 8. Кристаллогидраты Кристаллические вещества, содержащие молекулы воды, называются кристаллогидратами. CuSO4 · 5H2O Медный купорос Na2SO4 · 10H2O
- 9. Гидратная теория (1887 год) Д. И. Менделеев (1834–1907) «Растворы суть химические соединения, определяемые силами, действующими между
- 10. «Подобное растворяется в подобном…»
- 11. Растворение Уксусная кислота + вода Масло + вода
- 12. Растворение Q (растворения) = -Q (разрыв химических связей) + Q (образование химических связей) NaOH, H2SO4, AgNO3
- 13. Растворы Насыщенный Ненасыщенный Количественной характеристикой растворимости является коэффициент растворимости. Коэффициент растворимости показывает, какая максимальная масса вещества
- 14. Растворимость Вещества по растворимости Хорошо растворимые Малорастворимые Практически нерастворимые Растворимость вещества больше 1 г на 100
- 15. Растворимость Растворимость вещества зависит от: природы растворителя; природы растворённого вещества; температуры; давления (для газов). Растворимость, г/100
- 16. Кристаллизация приводит к образованию минералов.
- 17. Кристаллизация имеет большое значение в процессах, протекающих в почве.
- 18. Растворы Разбавленный Концентрированный Массовая доля растворённого вещества где ω – массовая доля растворённого вещества; m (в-ва)
- 19. Массовая доля растворённого вещества Дано: m (р-ра) = 200 г m (в-ва) = 40 г ω
- 20. Молярная концентрация где С – молярная концентрация, моль/л; n – количество растворённого вещества, моль; V –
- 21. Молярная концентрация Дано: V (р-ра) = 4 л m (NaOH) = 1,6 г C (NaOH) –
- 22. Молярная концентрация С, моль/л Обозначение молярности Название раствора 1 0,5 0,1 0,01 0,001 1 М 0,5
- 23. Количественный состав растворов Дано: ρ (р-ра) = 1,15 г/мл ω (H2SO4) = 20 % Решение: Ответ:
- 24. Массовая концентрация (титр) Дано: ρ (р-ра) = 1,012 г/мл ω (HNO3) = 15 % Т (HNO3)
- 26. Скачать презентацию




















 Липиды
Липиды Період як особлива синтаксична конструкція
Період як особлива синтаксична конструкція Глицерин. Свойства и применение
Глицерин. Свойства и применение Крекинг нефти
Крекинг нефти Аварийно-химически-опасные вещества (АХОВ). Описание. Методы оказания первой помощи
Аварийно-химически-опасные вещества (АХОВ). Описание. Методы оказания первой помощи Химическая связь
Химическая связь Приготовление растворов солей с определенной массовой долей растворенного вещества
Приготовление растворов солей с определенной массовой долей растворенного вещества Вода – это жизнь!
Вода – это жизнь! The production of stable isotopes
The production of stable isotopes Молибден. Нахождение в природе
Молибден. Нахождение в природе Предмет біоорганічної хімії. Класифікація, номенклатура, електронні уявлення, будова, реакційна здатність органічних сполук
Предмет біоорганічної хімії. Класифікація, номенклатура, електронні уявлення, будова, реакційна здатність органічних сполук Түймедақ гүлімен құрғақ теріге арналған ылғалдандырушы крем дайындау
Түймедақ гүлімен құрғақ теріге арналған ылғалдандырушы крем дайындау Аммиак
Аммиак Что нас объединяет?
Что нас объединяет? Таблицы. Определение характера оксидов
Таблицы. Определение характера оксидов Основи
Основи Методы оценки плотности и вязкости нефтей и нефтепродуктов
Методы оценки плотности и вязкости нефтей и нефтепродуктов Ионное произведение воды. Водородный показатель
Ионное произведение воды. Водородный показатель Ионы и ионная химическая связь
Ионы и ионная химическая связь Металлы главных подгрупп
Металлы главных подгрупп Производство извести
Производство извести Металлы. Свойства металлов
Металлы. Свойства металлов Химия. D-элементтер
Химия. D-элементтер Методы определения вязкости жидкости
Методы определения вязкости жидкости Химический состав клетки
Химический состав клетки Основні класи неорганічних сполук
Основні класи неорганічних сполук Алюминий (лат. Aluminium)
Алюминий (лат. Aluminium) Непредельные углеводороды. Алкины
Непредельные углеводороды. Алкины