Содержание
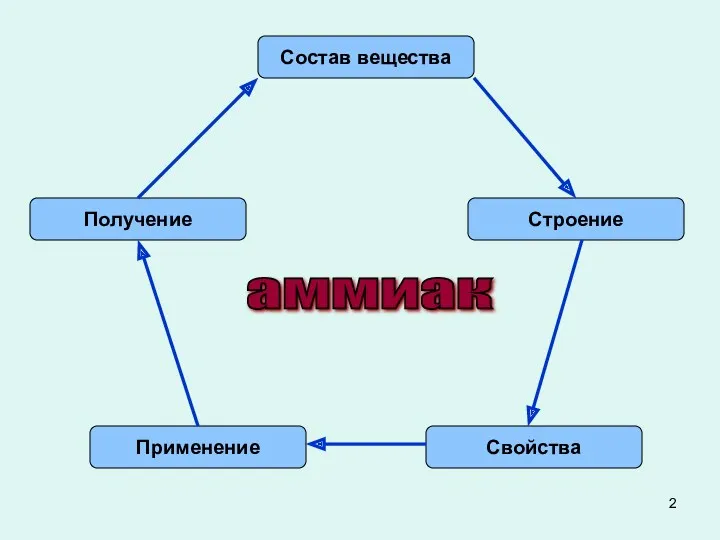
- 2. Состав вещества Строение Свойства Применение Получение аммиак
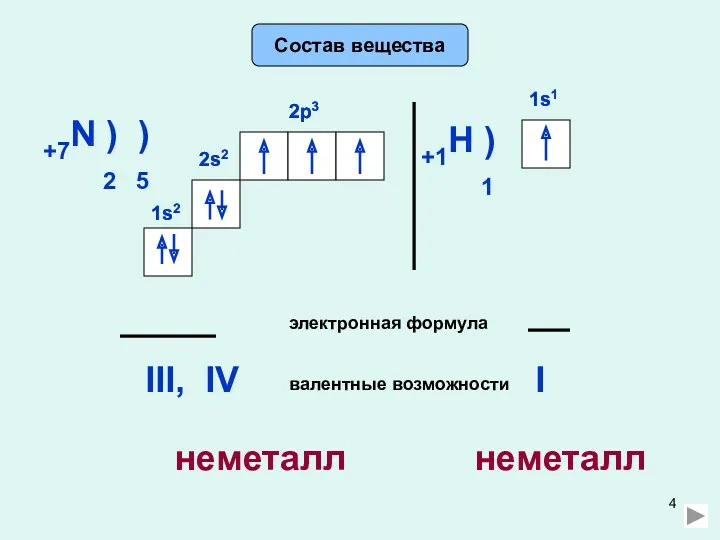
- 4. Состав вещества +7N ) ) 2 5 2s2 2p3 электронная формула 2s2 1s2 1s2 2p3 валентные
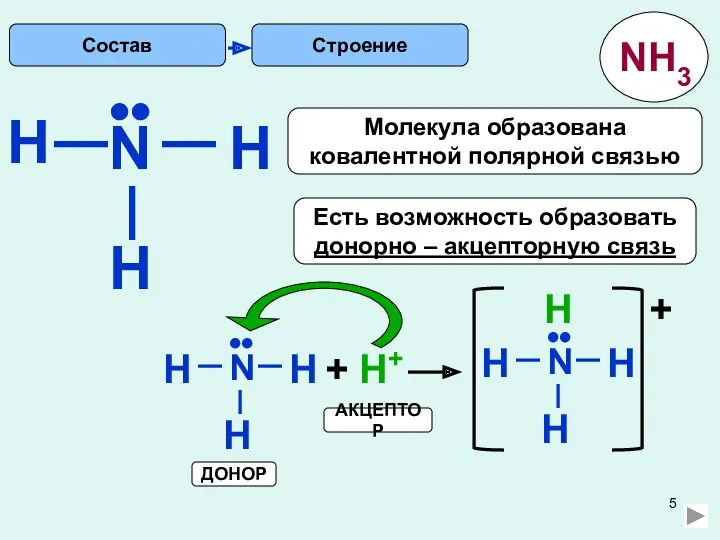
- 5. H Строение N H H •• Есть возможность образовать донорно – акцепторную связь Молекула образована ковалентной
- 6. NH NH 3 3 3 NH б- б+ б- б+ б- б+ Присутствие водородной связи в
- 7. Аммиак –это газ, бесцветный, с резким запахом, ядовитый, сжижается при –33,35 °С, затвердевает при –77,7 °С.
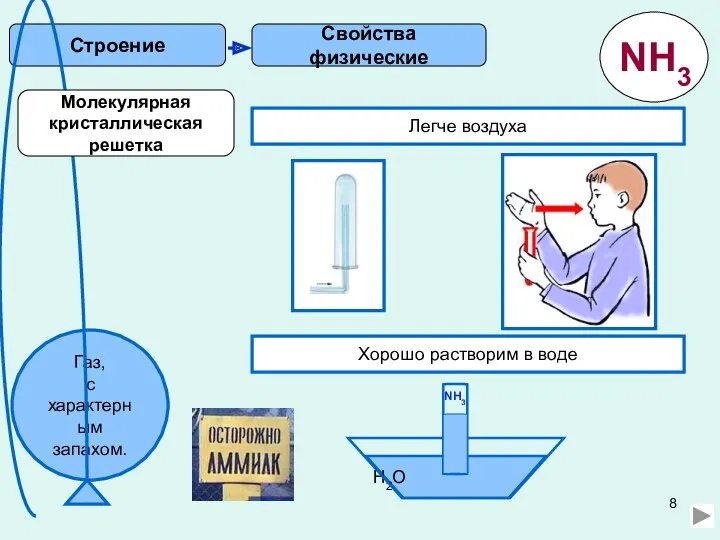
- 8. Свойства физические Строение Легче воздуха Хорошо растворим в воде H2O NH3 Молекулярная кристаллическая решетка
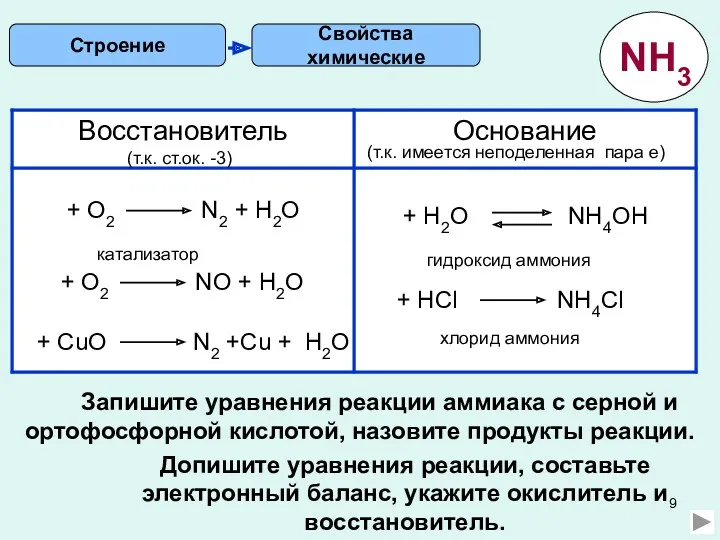
- 9. Свойства химические Строение (т.к. ст.ок. -3) (т.к. имеется неподеленная пара е) Допишите уравнения реакции, составьте электронный
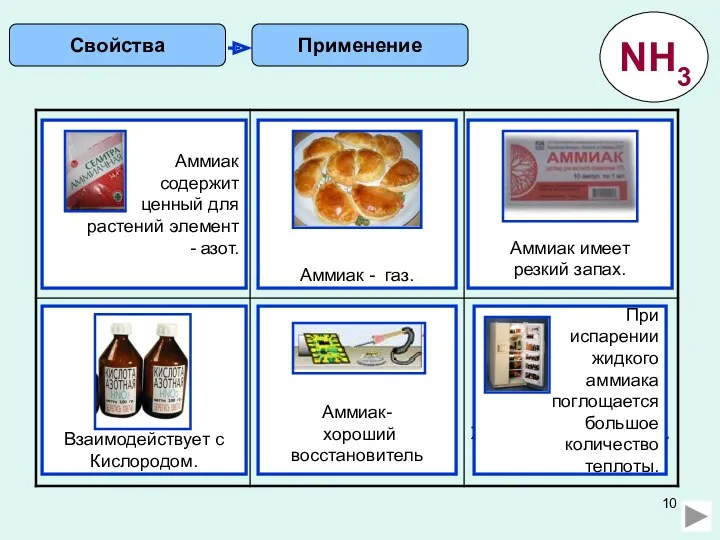
- 10. Применение Свойства
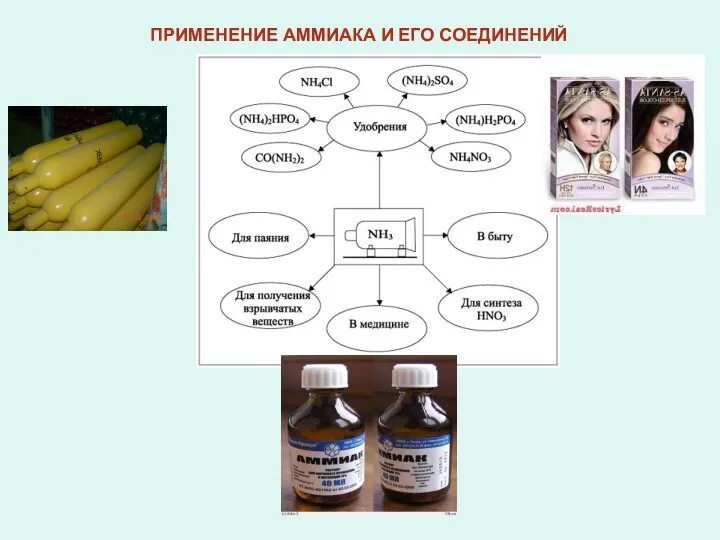
- 11. ПРИМЕНЕНИЕ АММИАКА И ЕГО СОЕДИНЕНИЙ
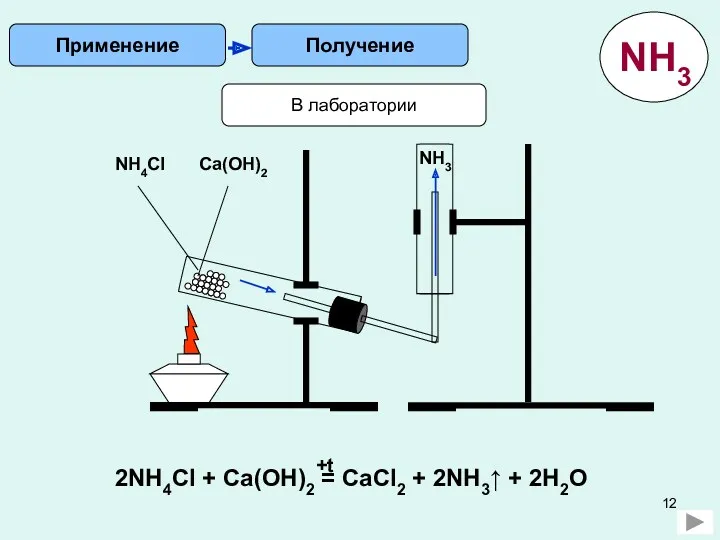
- 12. Получение Применение В лаборатории NH4Cl Ca(OH)2 NH3
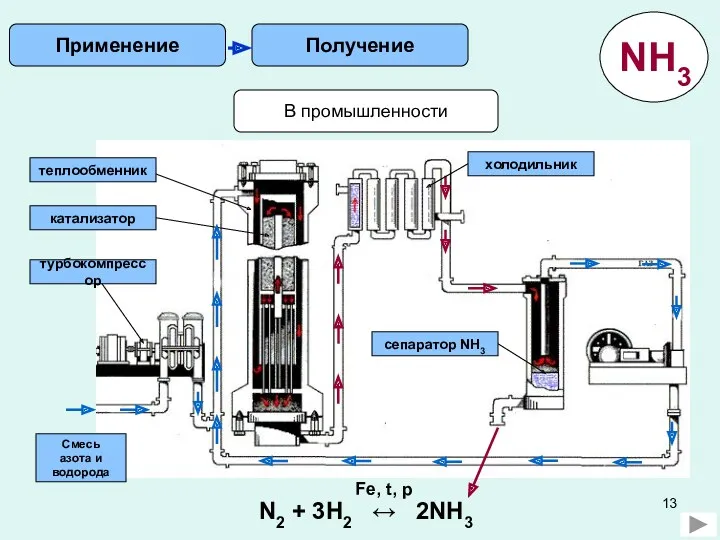
- 13. В промышленности Получение Применение Смесь азота и водорода турбокомпрессор катализатор теплообменник холодильник сепаратор NH3
- 14. Нельзя прикасаться к разлитому веществу, это может вызвать болезненный ожог кожных покровов. При утечке аммиака важно
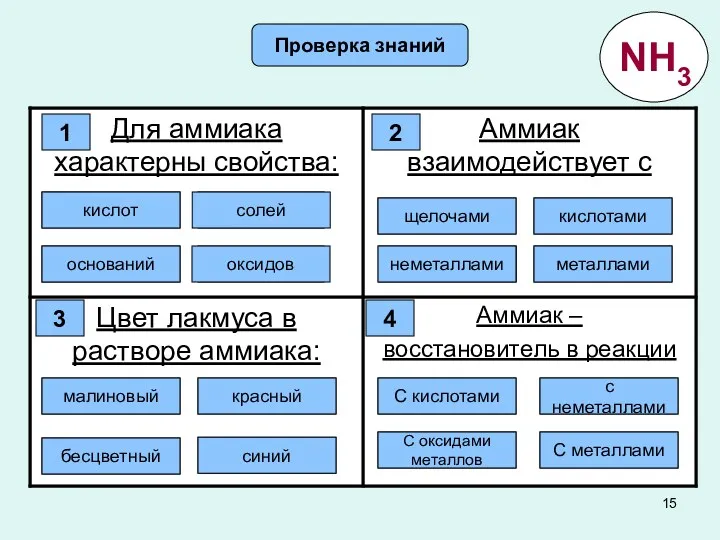
- 15. Проверка знаний Правильно! Ошибка Ошибка Ошибка 1 кислот солей оксидов оснований 2 Ошибка Правильно! Ошибка Ошибка
- 16. Проверь себя 1) Аммиак ____________ растворяется в воде. 2) Раствор аммиака в воде называют ___________ водой
- 18. Скачать презентацию





 Адсорбция на твердых телах
Адсорбция на твердых телах Барий. Щелочноземельные металлы
Барий. Щелочноземельные металлы Жидкие кристаллы
Жидкие кристаллы Тест: полимеры
Тест: полимеры Теория строения органического вещества. 10 класс
Теория строения органического вещества. 10 класс Экоэстафета. ученики 9 Б класса гимназии №6 г. Гродно
Экоэстафета. ученики 9 Б класса гимназии №6 г. Гродно Кислотно-основное титрование. Алкалиметрия
Кислотно-основное титрование. Алкалиметрия Экспериментальные методы физико-химических исследований. Лекция 7
Экспериментальные методы физико-химических исследований. Лекция 7 Алюминий. Строение и свойство атомов
Алюминий. Строение и свойство атомов Общая характеристика элементов VА-группы. Азот
Общая характеристика элементов VА-группы. Азот Технология монокристаллов и особо чистых веществ
Технология монокристаллов и особо чистых веществ Полимеры органические и неорганические
Полимеры органические и неорганические Спирты
Спирты Results of lab test NG RO: Bypass, UV-lamp, membrane Toray 3012 800-1000 GPD
Results of lab test NG RO: Bypass, UV-lamp, membrane Toray 3012 800-1000 GPD Методи очищення води в побуті
Методи очищення води в побуті Le trasformazioni fisiche della materia. Tema 3
Le trasformazioni fisiche della materia. Tema 3 Сложные эфиры. Жиры
Сложные эфиры. Жиры Жиры. История открытия, строение, классификация, свойства
Жиры. История открытия, строение, классификация, свойства Материаловедение как наука
Материаловедение как наука Способы получения и очистки металлов
Способы получения и очистки металлов Молекулы и атомы. Броуновское движение
Молекулы и атомы. Броуновское движение Нефть. Лекция 5
Нефть. Лекция 5 Воспользуйтесь ЛСМ Химические реакции
Воспользуйтесь ЛСМ Химические реакции Complex compounds
Complex compounds Окислительно-восстановительные реакции (ОВР). Лекция 6
Окислительно-восстановительные реакции (ОВР). Лекция 6 Понятие о СМС и моющем процессе
Понятие о СМС и моющем процессе Кислородсодержащие органические соединения
Кислородсодержащие органические соединения Карбоновые кислоты, их нахождение в природе и применение
Карбоновые кислоты, их нахождение в природе и применение