Содержание
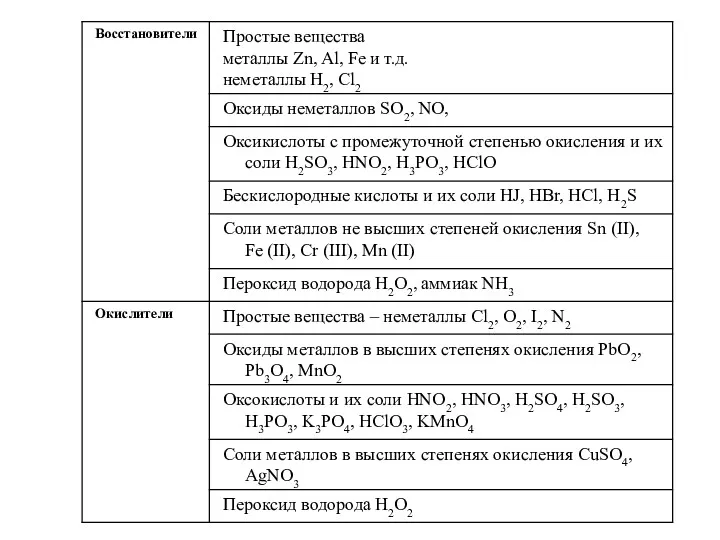
- 2. План лекции: Общие определения. ОВР и не ОВР. Понятия степень окисления, валентность, определение степени окисления в
- 4. Степень окисления простых веществ равна нулю: Н20, Cl20, S0, Са0 Степень окисления Ион водорода H в
- 5. Кислород О–2 чаще всего –2 (кроме H2O2, здесь кислород –1) max с.о. (O) = 0 (исключение:
- 6. max с.о. (Me) = + № группы min с.о. (Me) = 0 max с.о. (неMe) =
- 7. K+1N+ХO +1+Х + (–2)3 = 0 Х = +5 (N+ХO )– +Х + (–2)3 = –1
- 8. HNO3 H N O O O +1 -2 -2 -2 +5 c.о. N = +5 В
- 9. не ОВР HCl + KOH = KCl + H2O ОВР S4+O2 + N4+O2 = S6+O3 +
- 10. Окисление – процесс отдачи электронов реагирующей частицей (молекула, атом, ион), при которой степень окисления элемента повышается.
- 12. FeSO4 + KClO3 + H2SO4 = = Fe2(SO4)3 + KCl + 3H2O 1. Первый метод составления
- 13. б. Составляем электронный баланс. Fe2+ – 1e = Fe3+ 6 Cl5+ + 6e = Cl– 1
- 14. 2. Второй метод составления уравнений окислительно-восстановительных реакций - метод полуреакций (метод электронно-ионного баланса) 1). Составляем схемы
- 15. Правила для составления материального баланса: а). Недостаток «О» R+H2O→RO+2H+ в кислой или нейтральной среде R+2OH-→RO+H2O в
- 16. 3). Выполняем баланс зарядов NO2- + H2O – 2e- → NO3- + 2H+ MnO4- + 8H+
- 17. 6) Получаем следующее уравнение: 2MnO4- + 6H+ + 5NO2- → 5NO3- + 2Mn+2 + 3H2O На
- 18. 3. Третий метод составление уравнения ОВР с использованием таблицы стандартных окислительно-восстановительных потенциалов NO3- + 2H+ +
- 19. Энергия Гиббса ОВР: ΔGo = -nFEo, где n – число электронов, участвующих в процессах окисления (восстановления),
- 20. 5. Типы ОВР Межмолекулярная ОВР Mn4+O2+4HBr1– = Mn2+Br2+Br20+2H2O ок-ль в-ль Окислитель и восстановитель входят в состав
- 21. Внутримолекулярная ОВР 2KCl5+O = 2KCl1– + 3O ок-ль в-ль Окислитель и восстановитель – разные элементы, но
- 22. Реакция диспропорционирования (самоокисления-самовосстановления) 2N4+O2 + H2O → HN3+O2 + HN5+O3 N4+ + 1 = N3+ N4+
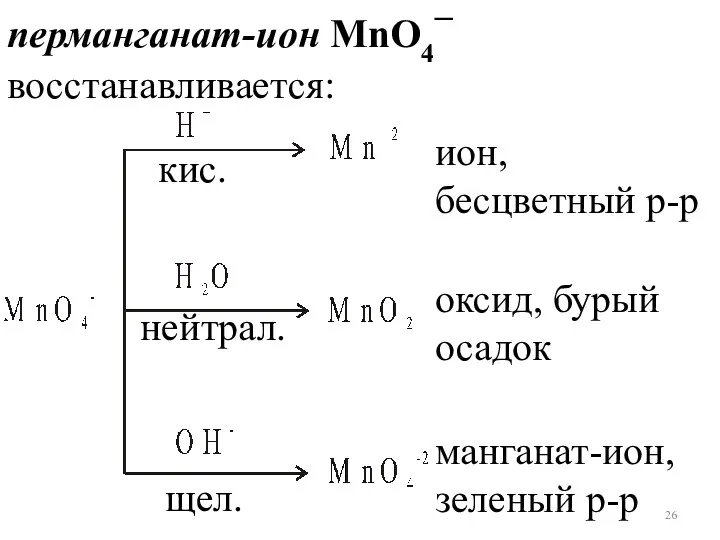
- 23. 6. Влияние среды на ОВР Перманганат калия KMnO4 1. Среда кислая 2KMn7+O4 + 5KN3+O2 + 3H2SO4
- 24. 2. Среда нейтральная 2KMn7+O4 + 3KN3+O2 + H2O = = 2Mn4+O2↓ + 3KN5+O3 + 2KOH Mn7+
- 25. 3. Среда щелочная 2KMn7+O4 + KN3+O2 + 2KOH = = 2K2Mn6+O4 + KN5+O3 + H2O Mn7+
- 26. ион, бесцветный р-р оксид, бурый осадок манганат-ион, зеленый р-р перманганат-ион MnO4– восстанавливается: кис. нейтрал. щел.
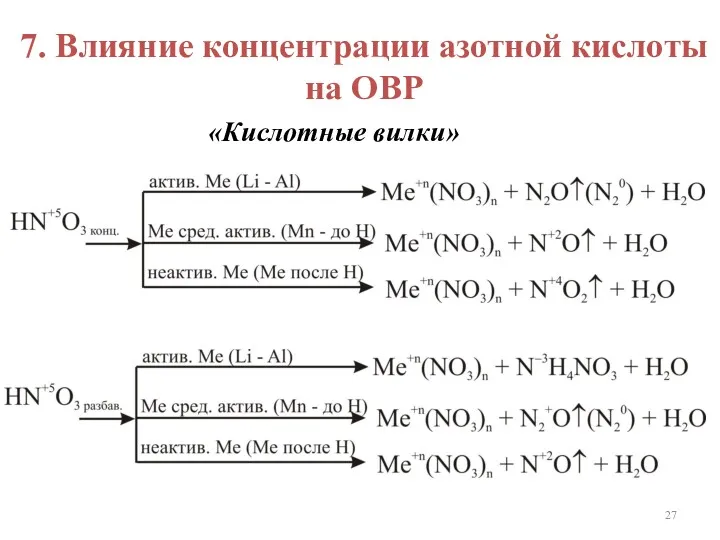
- 27. 7. Влияние концентрации азотной кислоты на ОВР «Кислотные вилки»
- 28. 7. Влияние концентрации азотной кислоты на ОВР Cu0 + 4HN5+O3(конц) = = Cu2+(NO3)2 + 2N4+O2↑ +
- 29. N5+ + 3e = N2+ 2 Cu0 – 2e = Cu2+ 3 ок-ль в-ль ок-е вос-е
- 30. Серная кислота H2SO4 Разбавленная серная кислота Mg + H2SO4 → MgSO4 + H2 8. Влияние концентрации
- 32. Скачать презентацию




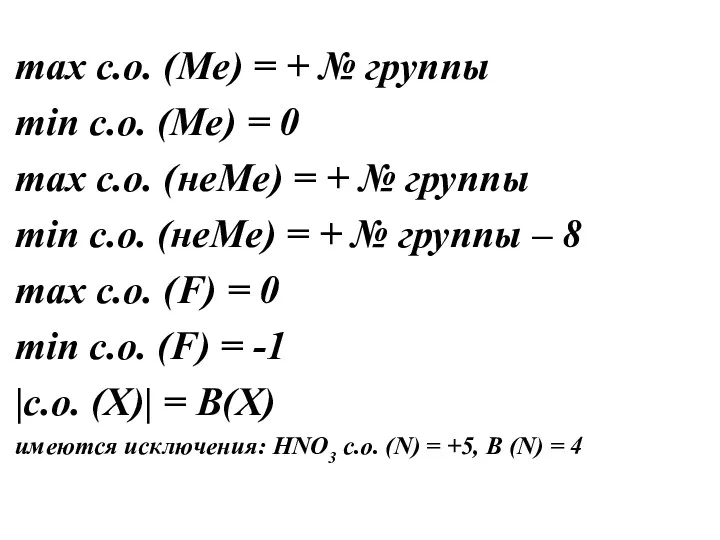
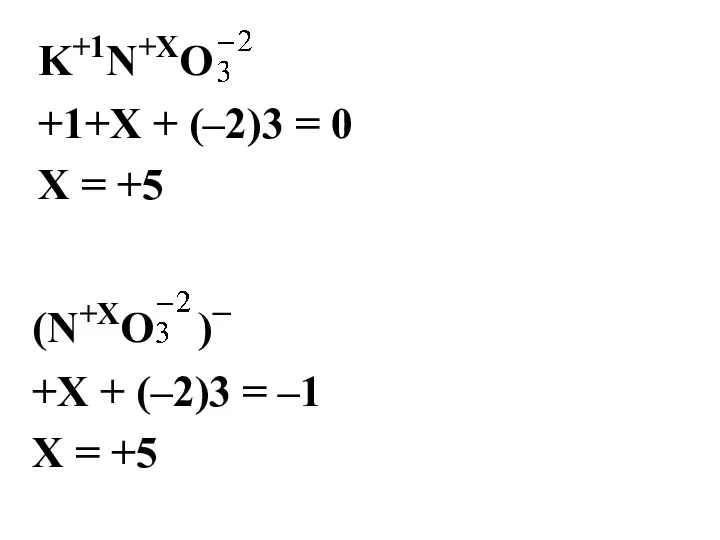
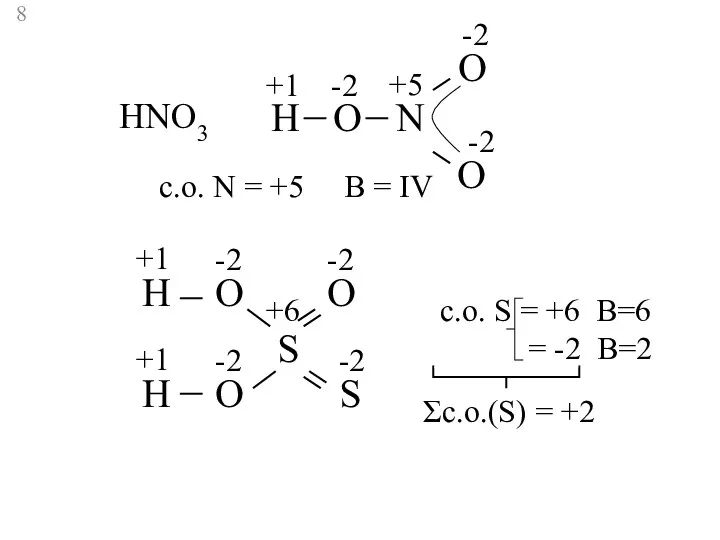
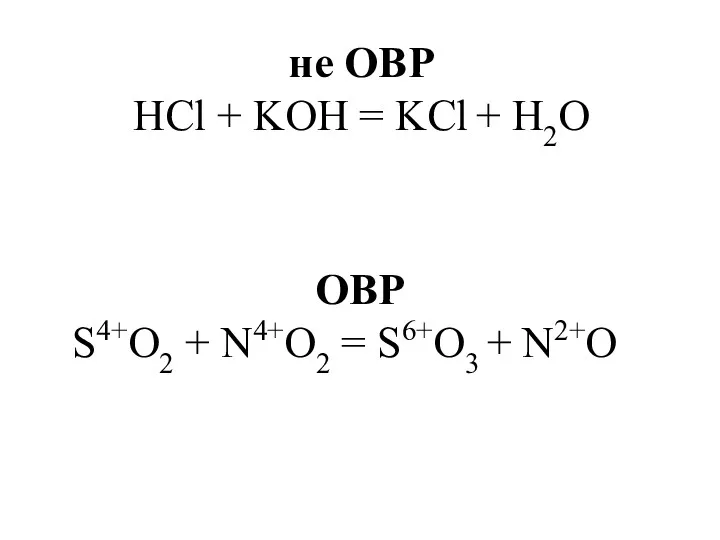


















 Основные классы неорганических веществ
Основные классы неорганических веществ Олимпиада по учебной дисциплине. Химия
Олимпиада по учебной дисциплине. Химия драгоценные и поделочные
драгоценные и поделочные Генетическая связь между классами веществ
Генетическая связь между классами веществ Основные электрохимические процессы
Основные электрохимические процессы Счастливый случай. Право первого хода
Счастливый случай. Право первого хода Метаморфические горные породы
Метаморфические горные породы Строение атома. Периодический закон и периодическая система элементов
Строение атома. Периодический закон и периодическая система элементов Строение и свойства металлов Физические и механические свойства металлов
Строение и свойства металлов Физические и механические свойства металлов Генетическая связь между классами неорганических веществ
Генетическая связь между классами неорганических веществ Көмірсулар. Моносахаридтер. Жіктелуі. Гексозалар. Құрылысы
Көмірсулар. Моносахаридтер. Жіктелуі. Гексозалар. Құрылысы Алотропні модифікації неметалів
Алотропні модифікації неметалів Химическая связь
Химическая связь Кислородсодержащие органические соединения
Кислородсодержащие органические соединения Растворы
Растворы Воздух, которым мы дышим
Воздух, которым мы дышим Медь. Химические свойства. Получение меди. Применение
Медь. Химические свойства. Получение меди. Применение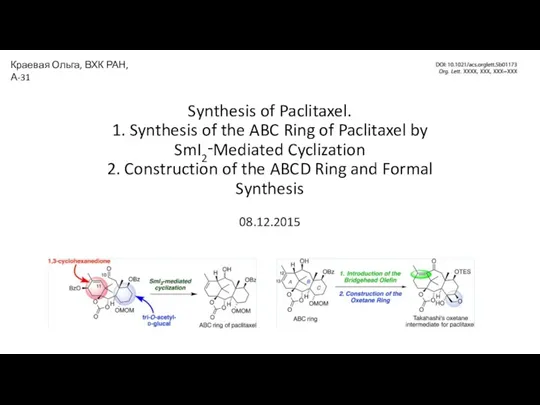 Synthesis of Paclitaxel
Synthesis of Paclitaxel Соединения кальция. Жесткость воды и способы её устранения
Соединения кальция. Жесткость воды и способы её устранения Катализ и катализаторы
Катализ и катализаторы Соединения железа
Соединения железа Элемент, имеющий относительную атомную массу
Элемент, имеющий относительную атомную массу Химическая посуда и лабораторное оборудование
Химическая посуда и лабораторное оборудование Disperse systems. True solution
Disperse systems. True solution Оксиди
Оксиди Кислород. Химия – 8 класс
Кислород. Химия – 8 класс Алканы
Алканы Игра по химии по теме Атомы химических элементов. Простые вещества
Игра по химии по теме Атомы химических элементов. Простые вещества