Содержание
- 2. Разминка Он в теченье многих лет был причиной многих бед. золото Был металл серебристо-белым, в соединении
- 3. О каком металле идет речь… Среди металлов самый славный Важнейший древний элемент. В тяжелой индустрии –
- 4. Итоговый тест. Отметить знаком «+» номер положения, которое считается верным Железо – это активный щелочной металл.
- 5. Ответы Вариант 1. – + – + + – – + Вариант 2. + – –
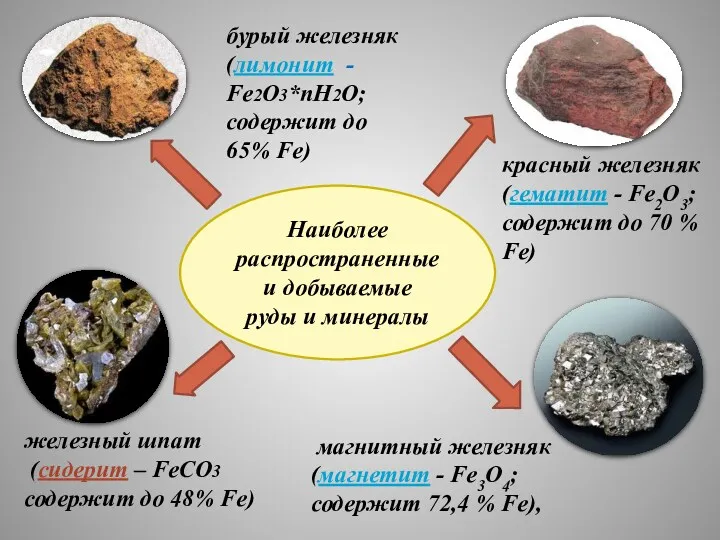
- 6. Наиболее распространенные и добываемые руды и минералы магнитный железняк (магнетит - Fe3O4; содержит 72,4 % Fe),
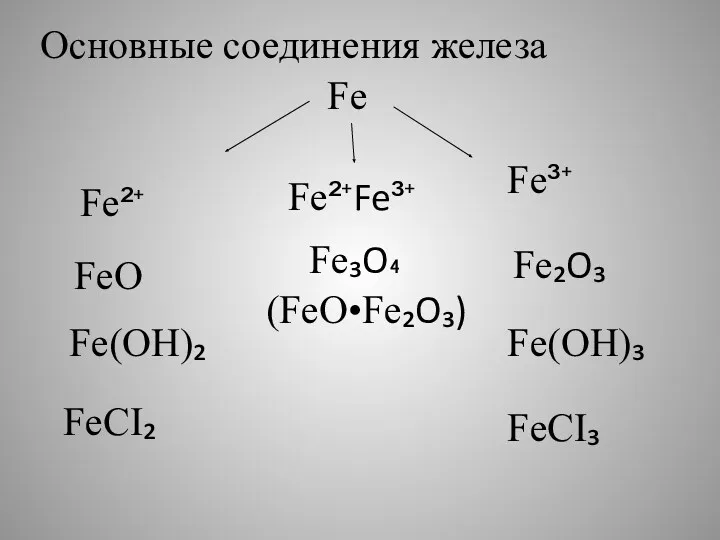
- 7. Fe Fe²⁺ Fe³⁺ FeO Fe(OH)₂ FeCI₂ Fe₂O₃ Fe(OH)₃ FeCI₃ Основные соединения железа Fe²⁺Fe³⁺ Fe₃O₄ (FeO•Fe₂O₃)
- 8. СОЕДИНЕНИЯ ЖЕЛЕЗА
- 9. СЕГОДНЯ НА УРОКЕ: 1. Оксиды и гидроксиды железа +2 и +3, их характер 2. Получение гидроксидов
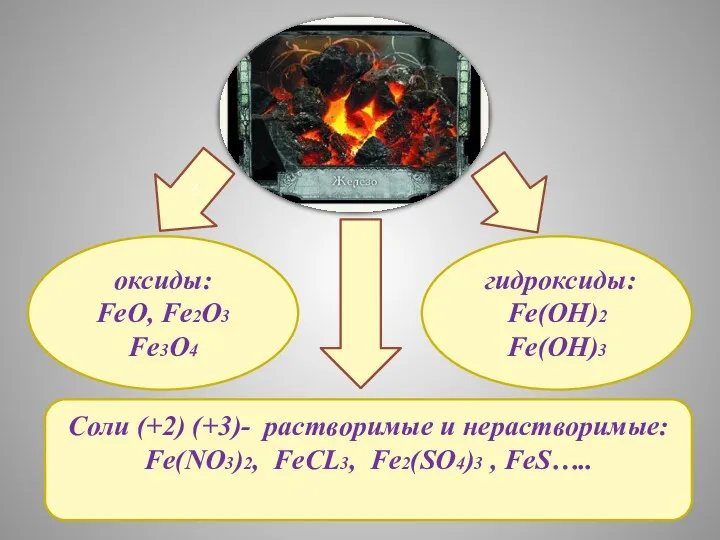
- 10. Соли (+2) (+3)- растворимые и нерастворимые: Fe(NO3)2, FeCL3, Fe2(SO4)3 , FeS….. оксиды: FeO, Fe2O3 Fe3O4 гидроксиды:
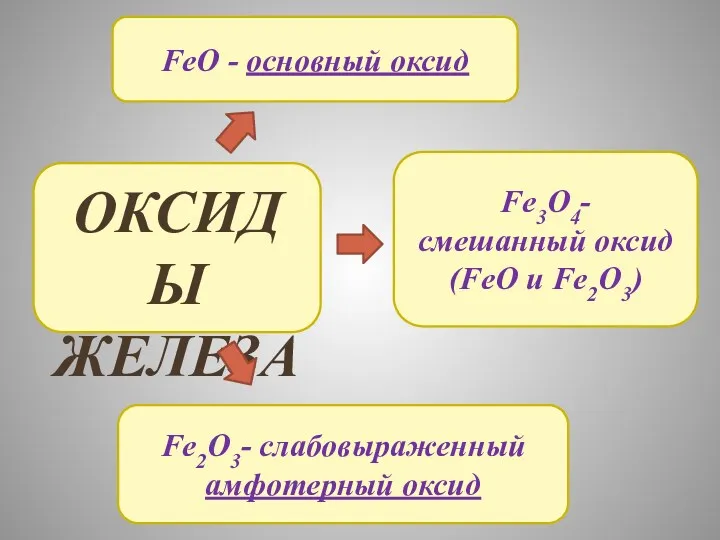
- 11. ОКСИДЫ ЖЕЛЕЗА FeO - основный оксид Fe2O3- слабовыраженный амфотерный оксид Fe3O4- смешанный оксид (FeO и Fe2O3)
- 12. Химические свойства FeO с кислотами: FeO + 2HCL=FeCL2 + H2O 2) с более активными металлами: 3FeO
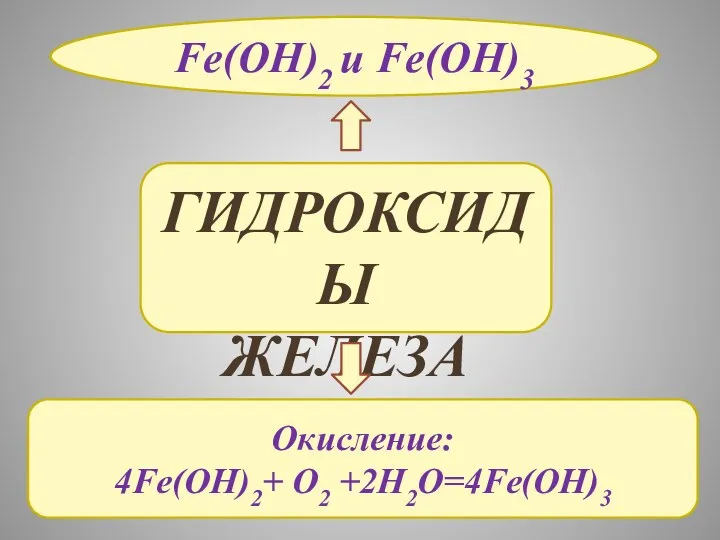
- 13. ГИДРОКСИДЫ ЖЕЛЕЗА Fe(OH)2 и Fe(OH)3 Окисление: 4Fe(OH)2+ O2 +2H2O=4Fe(OH)3
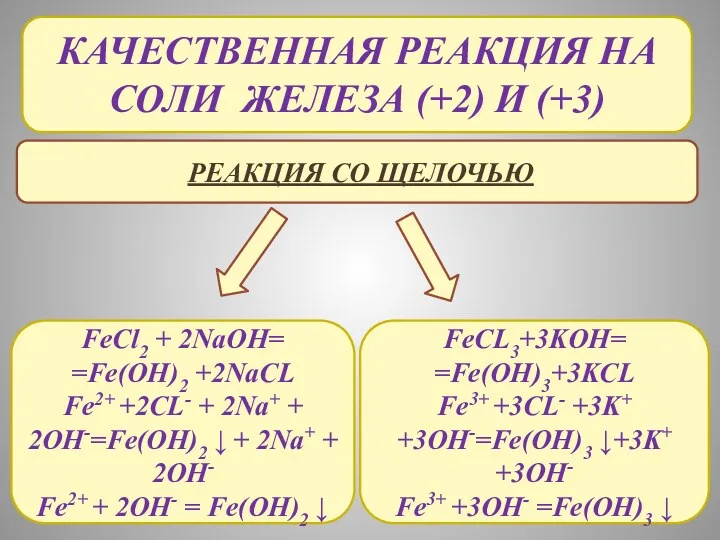
- 14. КАЧЕСТВЕННАЯ РЕАКЦИЯ НА СОЛИ ЖЕЛЕЗА (+2) И (+3) РЕАКЦИЯ СО ЩЕЛОЧЬЮ FeCl2 + 2NaOH= =Fe(OH)2 +2NaCL
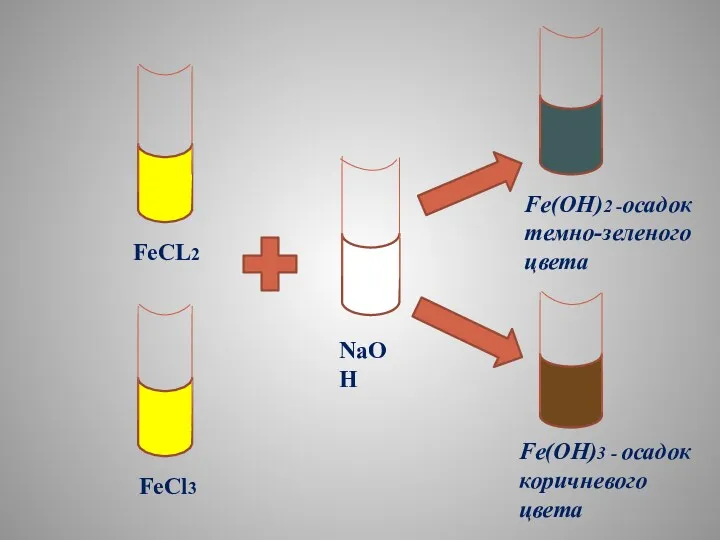
- 15. FeCL2 FeCl3 NaOH Fe(OH)2 -осадок темно-зеленого цвета Fe(OH)3 - осадок коричневого цвета
- 16. Качественные реакции на ионы Fe²⁺ и Fe³⁺ Fe³⁺ реактив – роданид калия KSCN Fe³⁺ реактив –
- 17. Fe(OH)2 и Fe(OH)3 Fe(OH)3 реагирует с конц. щелочами Fe(OH)3 + 3NaOH=Na3(Fe(OH)6) 1)Реагируют с кислотами: Fe(OH)2 +
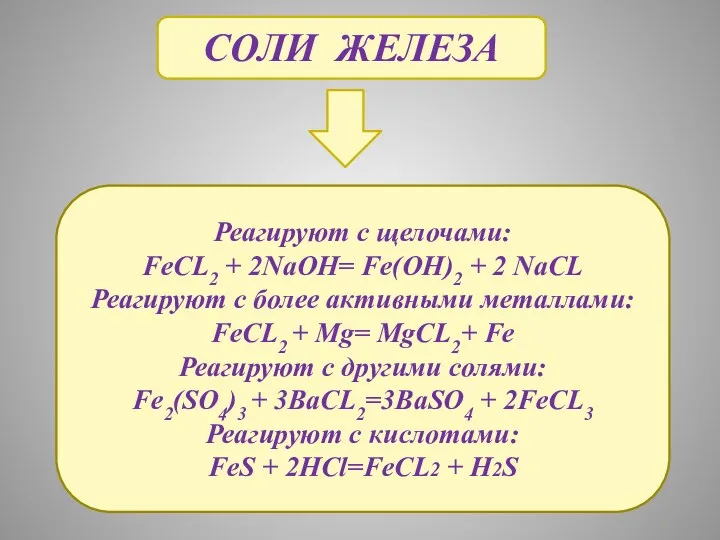
- 18. СОЛИ ЖЕЛЕЗА Реагируют с щелочами: FeCL2 + 2NaOH= Fe(OH)2 + 2 NaCL Реагируют с более активными
- 19. ЖЕЛЕЗО В ОРГАНИЗМЕ Железо в виде ионов присутствует в организмах всех растений и животных и, конечно
- 20. Основная роль железа в организме – участие в «рождении» красных (эритроцитов) и белых (лимфоцитов) кровяных клеток.
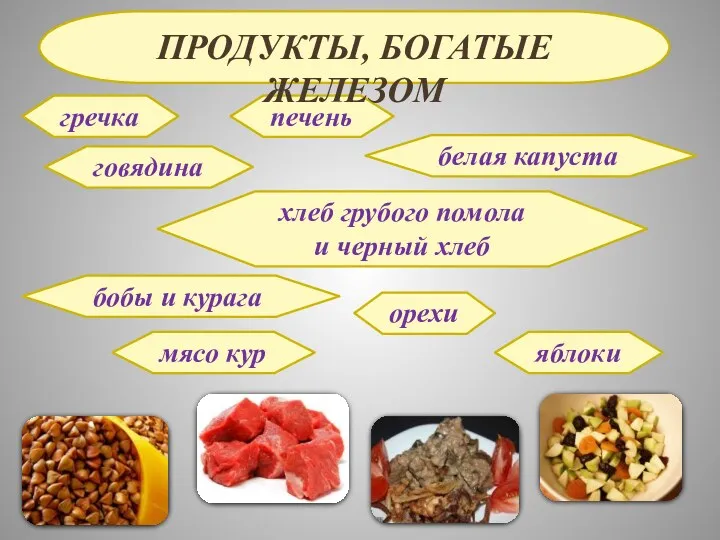
- 21. гречка говядина печень белая капуста хлеб грубого помола и черный хлеб бобы и курага орехи мясо
- 24. Токсичность железа Избыточная доза железа – 200мг и выше может вызвать отравление Железо занимает 5 –е
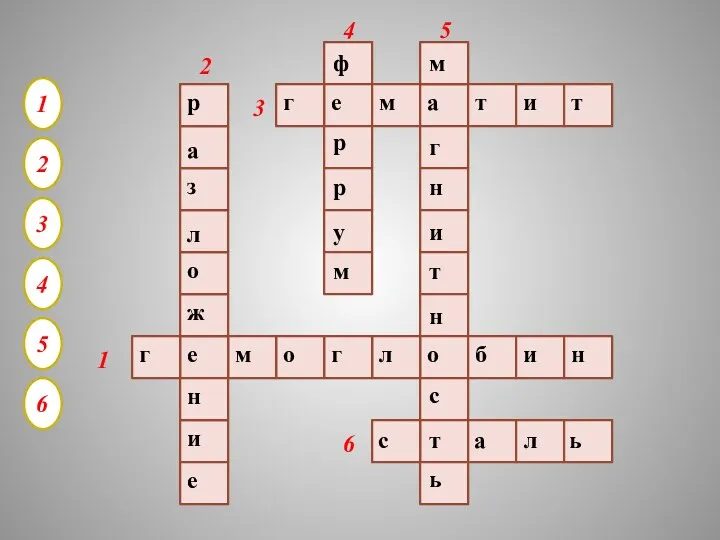
- 25. А Т Е П Е Р Ь К Р О С С В О Р Д
- 26. 1 2 3 4 5 6 г е м о г л о б и н
- 27. 1. БЕЛОК КРОВИ, ПЕРЕНОСЯЩИЙ ПО ОРГАНИЗМУ КИСЛОРОД 2. ТИП РЕАКЦИИ, В КОТОРУЮ ВСТУПАЮТ ГИДРОКСИДЫ ЖЕЛЕЗА ПРИ
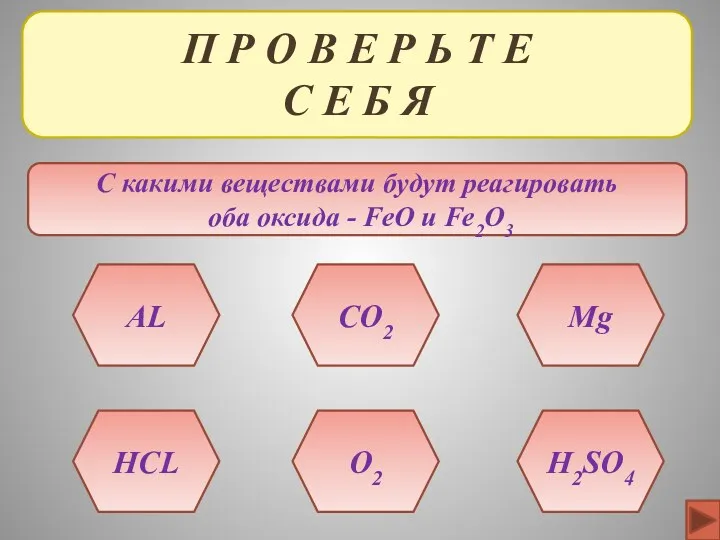
- 28. П Р О В Е Р Ь Т Е С Е Б Я С какими веществами
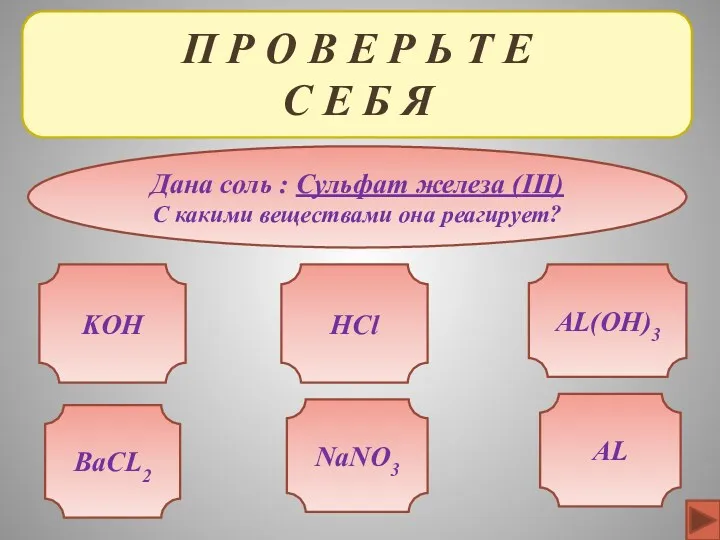
- 29. П Р О В Е Р Ь Т Е С Е Б Я Дана соль :
- 30. Домашнее задание § 44, упражнение 11(а,б) стр. 136 Задача 4 стр. 136, викторина (по желанию)
- 31. Спасибо за работу!
- 33. Скачать презентацию


















 Спектрофометрия
Спектрофометрия Характеристика s,p,d,f - элементов
Характеристика s,p,d,f - элементов Химическое кафе Кислоты
Химическое кафе Кислоты Експлуатаційні матеріали. Пальне для карбюраторних, дизельних двигунів. Змащувальні масла, пластичні мастила військової техніки
Експлуатаційні матеріали. Пальне для карбюраторних, дизельних двигунів. Змащувальні масла, пластичні мастила військової техніки Фосфор и его соединения. Электронные формулы атома фосфора
Фосфор и его соединения. Электронные формулы атома фосфора Тепловой эффект химических реакций. 8 класс
Тепловой эффект химических реакций. 8 класс Химия углеводов
Химия углеводов Пластмаси та їх роль у сучасному виробництві
Пластмаси та їх роль у сучасному виробництві Количество вещества, число Авогадро, молярная масса, молярный объём, уравнение связи
Количество вещества, число Авогадро, молярная масса, молярный объём, уравнение связи Основи. Властивості, застосування гідроксидів Натрію і Калію
Основи. Властивості, застосування гідроксидів Натрію і Калію Интересные факты о химических веществах
Интересные факты о химических веществах Observing change. Chemical reactions
Observing change. Chemical reactions Группа веществ, изолируемых полярными растворителями
Группа веществ, изолируемых полярными растворителями Периодическая система химических элементов Д.И. Менделеева. Знаки химических элементов
Периодическая система химических элементов Д.И. Менделеева. Знаки химических элементов Полимеры. Полимерные материалы
Полимеры. Полимерные материалы Crystal defects
Crystal defects Валентность химических элементов (8 класс)
Валентность химических элементов (8 класс) Диеновые углеводороды или алкадиены (тема 4)
Диеновые углеводороды или алкадиены (тема 4) Milk Composition. Proteins - Молоко
Milk Composition. Proteins - Молоко Капиллярная конденсация
Капиллярная конденсация Дисахаридтер. Сахароза
Дисахаридтер. Сахароза Періодична система хімічних елементів. Хімія. 8 клас
Періодична система хімічних елементів. Хімія. 8 клас Щелочные металлы
Щелочные металлы Альдегиды и кетоны
Альдегиды и кетоны Изучение упругости диссоциации карбоната кальция
Изучение упругости диссоциации карбоната кальция Дикарбоновые , гидроксикислоты
Дикарбоновые , гидроксикислоты Organic molecules
Organic molecules Обмен липидов
Обмен липидов