Содержание
- 2. Существует физическая величина, прямо пропорциональная числу частиц, составляющих данное вещество и входящих во взятую порцию этого
- 3. Количество вещества — физическая величина, характеризующая количество однотипных структурных единиц, которые содержатся в веществе. Под структурными
- 4. Молярная масса -это масса одного моля вещества. М=[г/моль] ( молярная масса численно равна молекулярной массе) ,
- 5. о Закон объемных отношений Измеряя объемы, и объемы газов, в результате реакции Ж.Л. Гей-Люссак открыл закон
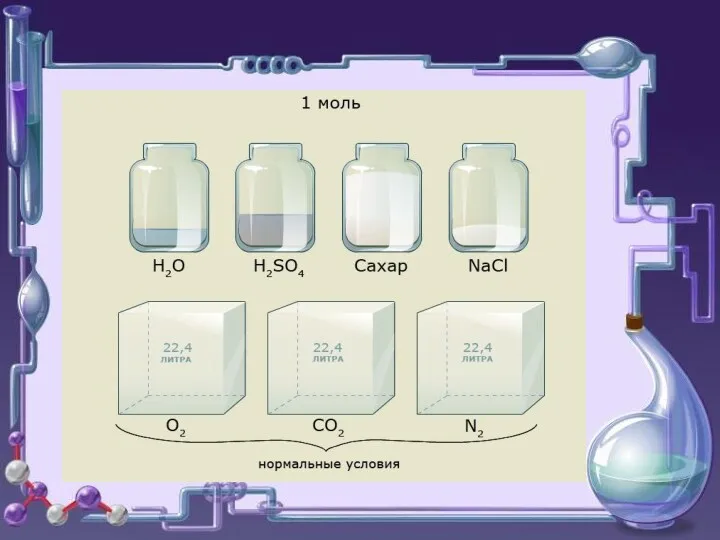
- 6. Например
- 7. Закон объёмных отношений позволил итальянскому учёному А. Авогадро предположить, что молекулы простых газов состоят из двух
- 8. о о А. Авогадро 1811 Итальянский ученый Амадео Авогадро сформулировал закон (для газов) : в равных
- 9. Следствия (для газов) Отношение массы определённого объёма одного газа к массе такого же объёма другого газа,
- 11. Уравнение связи Где n- количество вещества (моль)
- 13. Скачать презентацию


![Молярная масса -это масса одного моля вещества. М=[г/моль] ( молярная](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/285846/slide-3.jpg)






 Розв’язування задач за рівняннями реакцій з використанням розчинів із певною масовою часткою розчиненої речовини. Урок 13-14
Розв’язування задач за рівняннями реакцій з використанням розчинів із певною масовою часткою розчиненої речовини. Урок 13-14 Магия кристаллов
Магия кристаллов Пластмаси. Види пластмас. (11 клас)
Пластмаси. Види пластмас. (11 клас) Процессы и технологическая схема производства сегодня. АО Газпромнефть-ОНПЗ
Процессы и технологическая схема производства сегодня. АО Газпромнефть-ОНПЗ Производство полимеров
Производство полимеров Массасы 4,2 г көміртек (IV) оксиді сумен әрекеттескенде қанша грамм көмір қышқылы (Н2СО3) түзілетінін есепте
Массасы 4,2 г көміртек (IV) оксиді сумен әрекеттескенде қанша грамм көмір қышқылы (Н2СО3) түзілетінін есепте Геохимия гидротермального процесса
Геохимия гидротермального процесса Защита металлоконструкций от коррозии
Защита металлоконструкций от коррозии Химия металлов: влияние металлов на организм человека
Химия металлов: влияние металлов на организм человека Типы химических реакций
Типы химических реакций Органическая химия
Органическая химия Химия титанорганических соединений
Химия титанорганических соединений Соли и их свойства
Соли и их свойства Соединения серы
Соединения серы Химическая связь
Химическая связь Нанотехнологии в школьном образовании. Семинар учителей химии
Нанотехнологии в школьном образовании. Семинар учителей химии Генетическая связь между классами веществ
Генетическая связь между классами веществ Беломорская соль, проектная работа
Беломорская соль, проектная работа Химические свойства спиртов
Химические свойства спиртов Моделирование, как метод научного исследования. Ограниченный метод Хартри-Фока
Моделирование, как метод научного исследования. Ограниченный метод Хартри-Фока Арилалкиламины, гидроксифенилалкиламины и их производные
Арилалкиламины, гидроксифенилалкиламины и их производные Значение органической химии в жизни человека
Значение органической химии в жизни человека Классификация химических реакций
Классификация химических реакций Полезные геологические химические соединения. Получение меди из малахита
Полезные геологические химические соединения. Получение меди из малахита Механическая смесь и растворы
Механическая смесь и растворы Общая характеристика реакций органических соединений. Кислотные и основные свойства органических соединений
Общая характеристика реакций органических соединений. Кислотные и основные свойства органических соединений Применение солей
Применение солей Распределение электронов в атомах. 8 класс
Распределение электронов в атомах. 8 класс