Содержание
- 2. Разрушение одной из двух связей в реакциях гидроксисоединений
- 3. —С → О ← H .. .. δ+ δ+ δ- Отщепление H+ (кислотные свойства) Взаимодействие с
- 4. Гидроксисоединения могут вступать в многочисленные реакции, давая различные классы соединений.
- 5. Общие закономерности реакций спиртов: – реакционная способность первичных одноатомных спиртов выше, чем вторичных; – вторичные спирты
- 6. Взаимодействие с активными металлами (щелочными и щёлочноземельными) При взаимодействии с активными металлами спирты проявляют свойства слабых
- 7. Алкоголяты химически не стабильны и при действии воды гидролизуются с образованием спирта и гидроксида металла. C2H5OК
- 8. Спирты не взаимодействуют с растворами щелочей.
- 9. HO—CH2—CH2—OH + 2NaOH = = NaO—CH2—CH2—ONa + 2H2O
- 10. Окисление спиртов Дихромат калия (K2Cr2O7) Перманганат калия (КМnО4) С2Н5ОH → H3C—C — — H О —
- 11. Восстановление спиртов Восстановление спиртов приводит к образованию углеводородов, содержащих то же количество атомов углерода, что и
- 12. Взаимодействие с галогенводородом H3C—CH2—CH2—CH2—OH → → H3С—CH2—CH2—СН3 LiAlH4 - H2O LiAlH4 - H2O бутанол бутан
- 13. Дегидратация спиртов Реакция дегидратации — это реакция отщепления воды (проводится в присутствии водоотнимающего средства). При этом
- 14. Дегидратация спиртов Реакция дегидратации — это реакция отщепления воды (проводится в присутствии водоотнимающего средства). При этом
- 15. Реакции спиртов с минеральными и органическими кислотами с образованием сложных эфиров СH3—CООH + HOCH3 CH3—COOCH3 +
- 16. Горение спирта С2Н5ОН + 3О2 → 2СО2 + 3Н2О ∆Н = -1374 кДЖ
- 17. Спирты можно использовать для получения всевозможных органических соединений, применяемых в качестве органических растворителей при производстве полимеров,
- 18. Метиловый спирт (метанол) (СН3OH) Формальдегид (CH2O)
- 19. Большие объёмы метанола используют при добыче и транспорте природного газа.
- 20. Метанол — наиболее токсичное соединение среди всех спиртов.
- 21. Этанол — исходное соединение для получения ацетальдегида, уксусной кислоты, а также для производства сложных эфиров карбоновых
- 22. Этанол — основной компонент всех спиртных напитков, его широко применяют в медицине как дезинфицирующее средство. VanHelsing.16
- 23. Бутанол используют как растворитель жиров и смол, кроме того, он служит сырьём для получения душистых веществ.
- 24. Бензиловый спирт (С6Н5—CH2—OH) Жасмин Гиацинт
- 26. Скачать презентацию
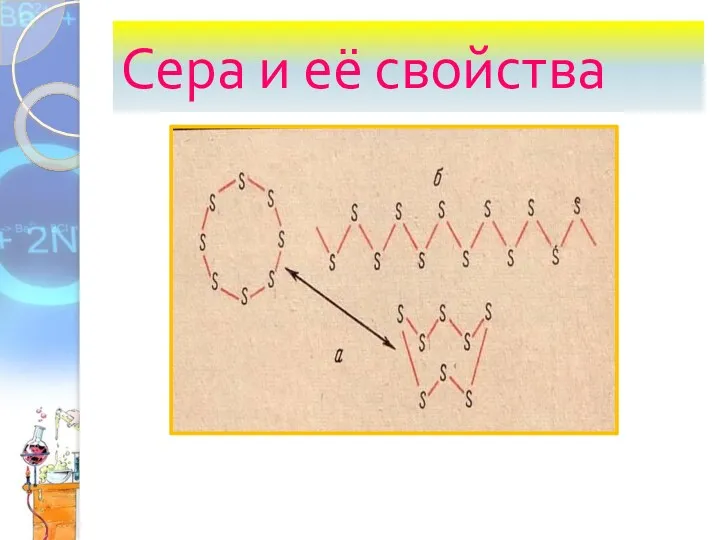 Сера и её свойства
Сера и её свойства Озон. Строние молекулы озона
Озон. Строние молекулы озона Предмет аналитической химии и ее основные понятия
Предмет аналитической химии и ее основные понятия Поняття про валентність. Ребус
Поняття про валентність. Ребус Соли в свете теории электролитической диссоциации
Соли в свете теории электролитической диссоциации Реакции ионного обмена. Ионное произведение воды. Водородный показатель. Индикаторы
Реакции ионного обмена. Ионное произведение воды. Водородный показатель. Индикаторы Алканы: общая формула, состав, гомологический ряд
Алканы: общая формула, состав, гомологический ряд Геохимические классификации элементов
Геохимические классификации элементов Облучение. Радиационная окраска
Облучение. Радиационная окраска Окислительные свойства серной и азотной кислот
Окислительные свойства серной и азотной кислот Реакции ионного обмена между растворами электролитов
Реакции ионного обмена между растворами электролитов Изотопная геохимия нефти и газа. Применение и стабильных изотопов в геологии
Изотопная геохимия нефти и газа. Применение и стабильных изотопов в геологии Вирощення кристталів
Вирощення кристталів Получение порошков автоклавным осаждением
Получение порошков автоклавным осаждением Сера. Аллотропные модификации
Сера. Аллотропные модификации Положение в периодической системе Менделеева водорода, лантаноидов, актиноидов и искусственно полученных элементов
Положение в периодической системе Менделеева водорода, лантаноидов, актиноидов и искусственно полученных элементов Растворы. Основные понятия. Концентрация. Законы Рауля
Растворы. Основные понятия. Концентрация. Законы Рауля 20230205_okislitelno-vosstanovitelnye_reaktsii
20230205_okislitelno-vosstanovitelnye_reaktsii Осадочные и метаморфические горные породы
Осадочные и метаморфические горные породы Соли в свете теории электролитической диссоциации
Соли в свете теории электролитической диссоциации Фотолабораторный процесс. Основные этапы фото обработки. Рентгеновского изображения
Фотолабораторный процесс. Основные этапы фото обработки. Рентгеновского изображения Неметаллы: общая характеристика
Неметаллы: общая характеристика Электроповерхностные явления. Строение двойного электрического слоя
Электроповерхностные явления. Строение двойного электрического слоя Правила техники безопасности в химическом кабинете. Правила пользования лабораторным оборудованием и нагревательными приборами
Правила техники безопасности в химическом кабинете. Правила пользования лабораторным оборудованием и нагревательными приборами Периодический закон и периодическая система химических элементов Д.И. Менделеева
Периодический закон и периодическая система химических элементов Д.И. Менделеева Химические вещества и материалы в индустрии красоты. Номенклатура и классификация органических соединений
Химические вещества и материалы в индустрии красоты. Номенклатура и классификация органических соединений Кислоты, их состав и названия
Кислоты, их состав и названия Гранулометрический состав горных пород
Гранулометрический состав горных пород