Содержание
- 2. Сера принадлежит к числу веществ, известных человечеству испокон веков. Ещё древние греки и римляне нашли ей
- 3. В живой природе: Входит в состав животных и растительных белков, витаминов, гормонов. СЕРА В ПРИРОДЕ Сера
- 4. СЕРА nº=16 p+=16 ē=16 Z=+16 Степени окисления серы: −2 (окислительные свойства); 0; +2, +4, +6 (восстановительные
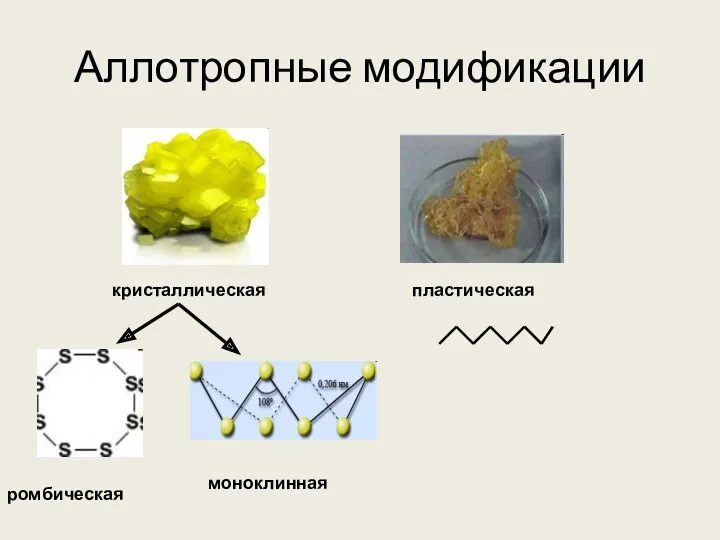
- 5. Аллотропные модификации кристаллическая пластическая ромбическая моноклинная
- 6. Кристаллическая, пластическая и моноклинная сера
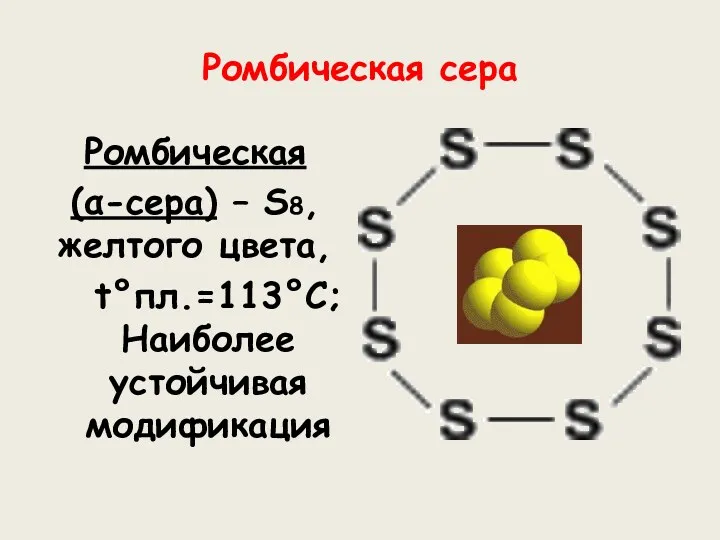
- 7. Ромбическая сера Ромбическая (α-сера) – S8, желтого цвета, t°пл.=113°C; Наиболее устойчивая модификация
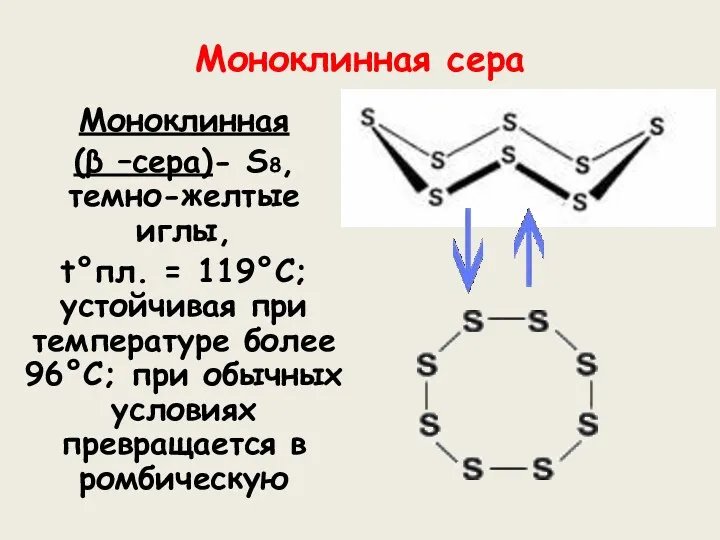
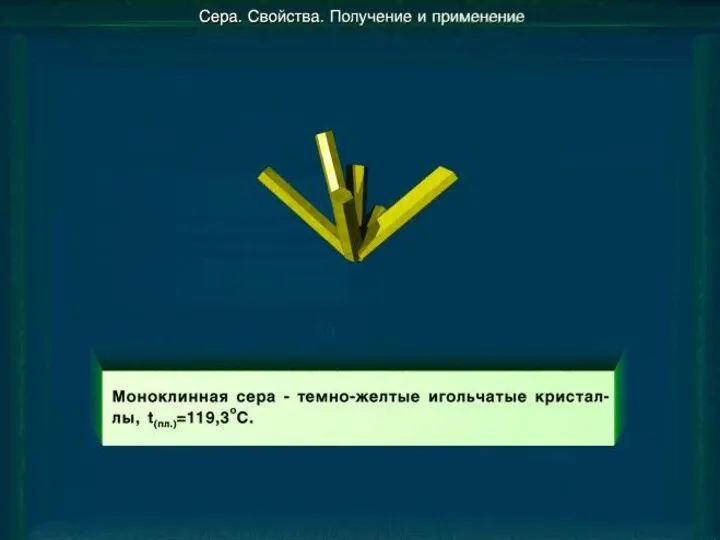
- 9. Моноклинная сера Моноклинная (β –сера)- S8, темно-желтые иглы, t°пл. = 119°C; устойчивая при температуре более 96°С;
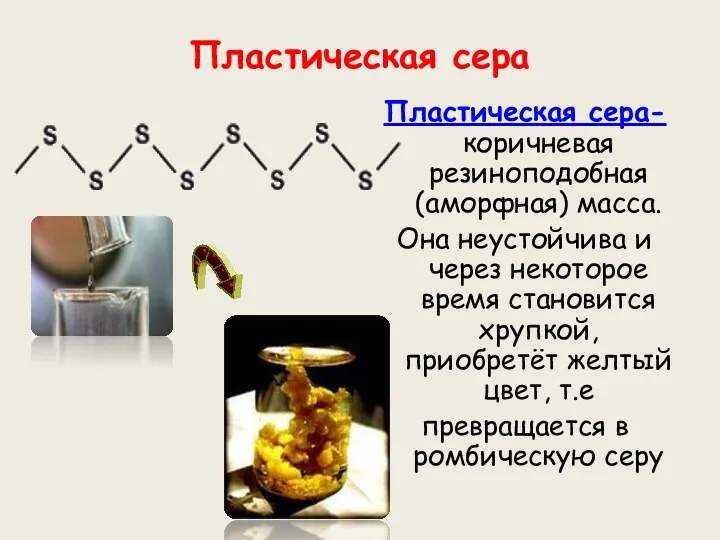
- 11. Пластическая сера Пластическая сера- коричневая резиноподобная (аморфная) масса. Она неустойчива и через некоторое время становится хрупкой,
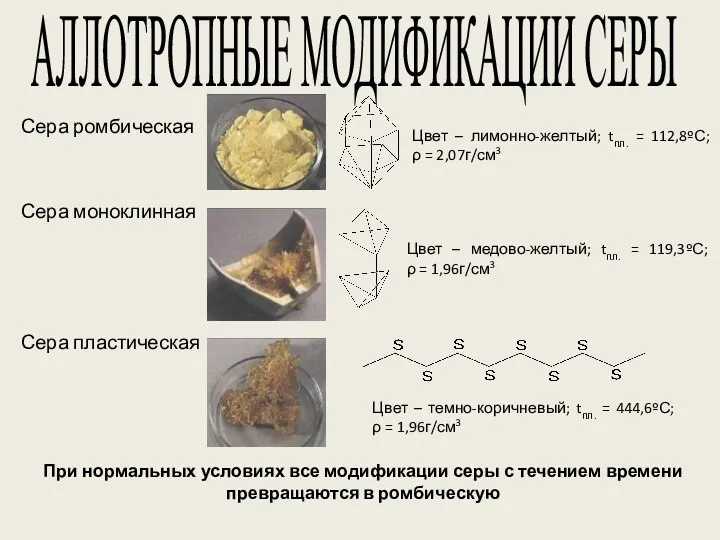
- 13. АЛЛОТРОПНЫЕ МОДИФИКАЦИИ СЕРЫ Сера ромбическая Сера пластическая Сера моноклинная Цвет – лимонно-желтый; tпл. = 112,8ºС; ρ
- 14. ФИЗИЧЕСКИЕ СВОЙСТВА СЕРЫ Сера – твердое кристаллическое вещество, не имеет запаха Не растворяется в воде. Хорошо
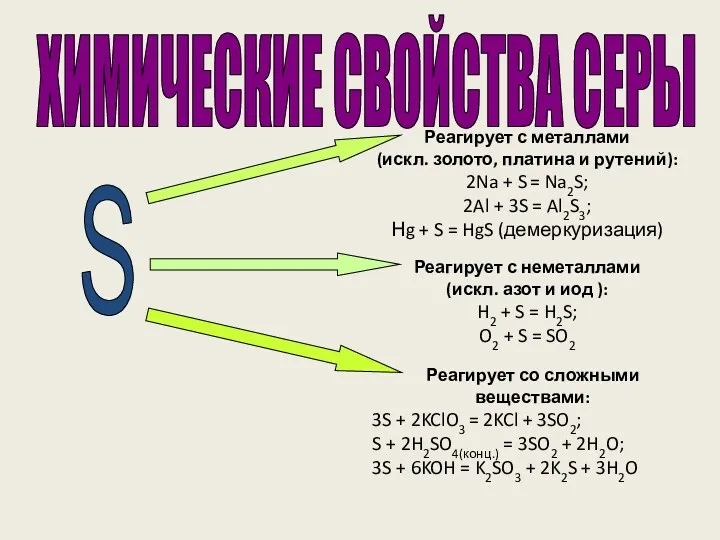
- 15. ХИМИЧЕСКИЕ СВОЙСТВА СЕРЫ S Реагирует с металлами (искл. золото, платина и рутений): 2Na + S =
- 16. ПОЛУЧЕНИЕ СЕРЫ Неполное окисление сероводорода: 2H2S + O2 = 2S↓ + 2H2O (недостаток O2). 2. Реакция
- 17. Нахождение серы в природе Сера является на 16-м месте по распространённости в земной коре. Встречается в
- 18. Сера в природе Самородная Сульфидная: Сероводород H2S Цинковая обманка ZnS Киноварь HgS Свинцовый блеск PbS Пирит
- 19. Сера также встречается в виде сульфатов - солей серной кислоты - мирабилит
- 20. Пирит – «огненный камень» (соединение серы в природе)
- 21. Сера входит в состав белков. Особенно много серы в белках волос, рогов, шерсти. Кроме этого сера
- 22. Серой богаты бобовые растения (горох, чечевица), овсяные хлопья, яйца
- 23. S
- 24. Сера используется для производства: - серной кислоты; - гидросульфита кальция Сa(HSO3)2 (для целлюлозной промышленности); - охотничьего
- 26. Скачать презентацию















 Алкены (олефины). 10 профиль. Лекция №1
Алкены (олефины). 10 профиль. Лекция №1 Побочная подгруппа. 8 группы
Побочная подгруппа. 8 группы Щелочи
Щелочи Химическая промышленность. 9 класс
Химическая промышленность. 9 класс Углерод и кремний
Углерод и кремний Технология производства аминоальдегидных смол
Технология производства аминоальдегидных смол Химическая связь и ее типы
Химическая связь и ее типы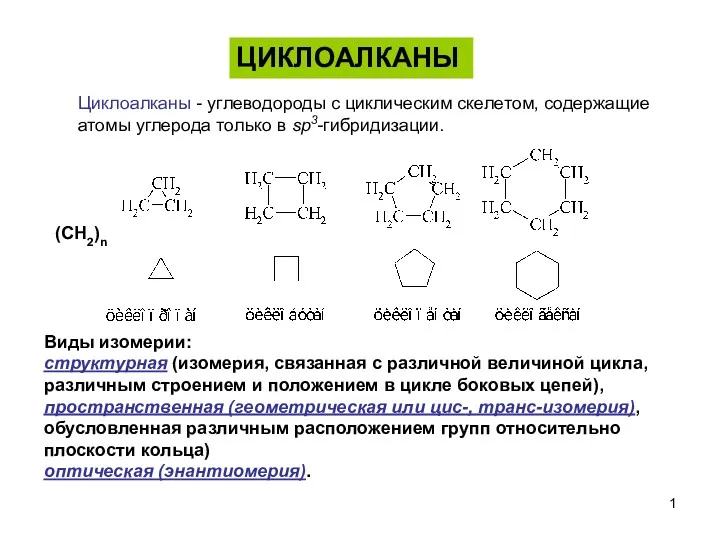 Циклоалканы
Циклоалканы Бериллий. Строение элемента. Физические и химические свойства. Способы получения. Применение. Интересные факты. Опыты
Бериллий. Строение элемента. Физические и химические свойства. Способы получения. Применение. Интересные факты. Опыты Практическая работа № 3. Получение, собирание и распознавание газов
Практическая работа № 3. Получение, собирание и распознавание газов Химическая промышленность России
Химическая промышленность России Общая характеристика металлов
Общая характеристика металлов Азотная кислота. Соли азотной кислоты. Получение и применение (9 класс)
Азотная кислота. Соли азотной кислоты. Получение и применение (9 класс)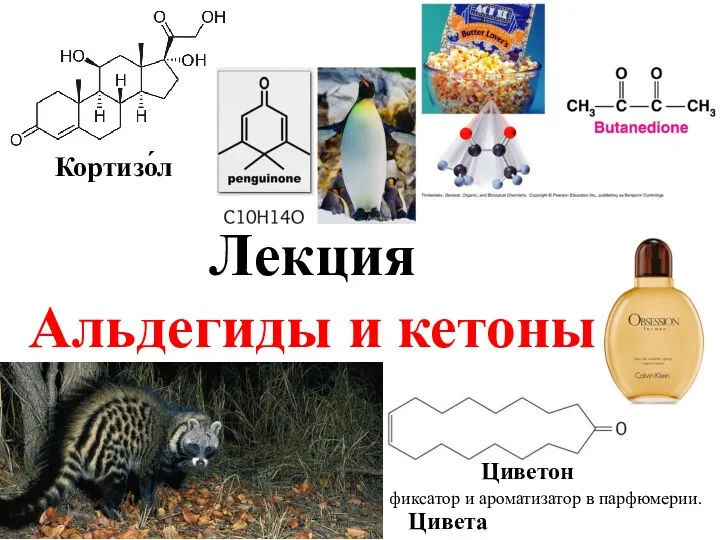 Альдегиды и кетоны. Циветон
Альдегиды и кетоны. Циветон Кислород
Кислород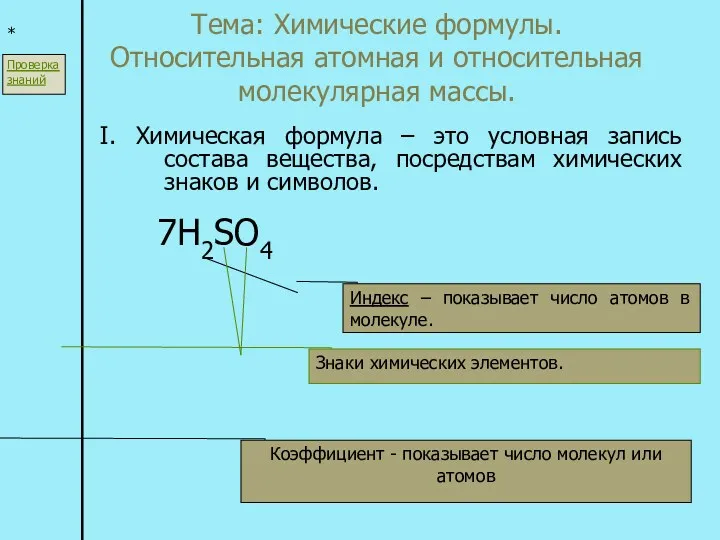 Химические формулы. Относительная атомная и относительная молекулярная массы
Химические формулы. Относительная атомная и относительная молекулярная массы Silicon. Silicate minerals. Weathering
Silicon. Silicate minerals. Weathering Возникновение и развитие органической химии. Теория химического строения. Структурные формулы
Возникновение и развитие органической химии. Теория химического строения. Структурные формулы Комплексиметрическое титрование
Комплексиметрическое титрование НОМЕНКЛАТУРА ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
НОМЕНКЛАТУРА ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ сложные эфиры
сложные эфиры Классификация химических реакций, протекающих с изменением состава веществ
Классификация химических реакций, протекающих с изменением состава веществ Магний (Mg)
Магний (Mg) Реакции ионного обмена
Реакции ионного обмена Соединения железа
Соединения железа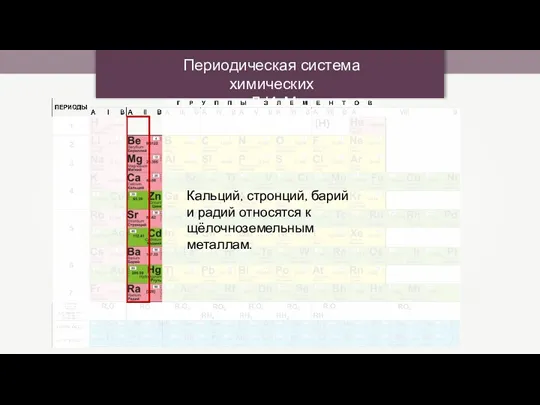 Периодическая система химических элементов Д.И. Менделеева
Периодическая система химических элементов Д.И. Менделеева Organic compounds: nomenclature
Organic compounds: nomenclature Месторождения нефрита
Месторождения нефрита