Содержание
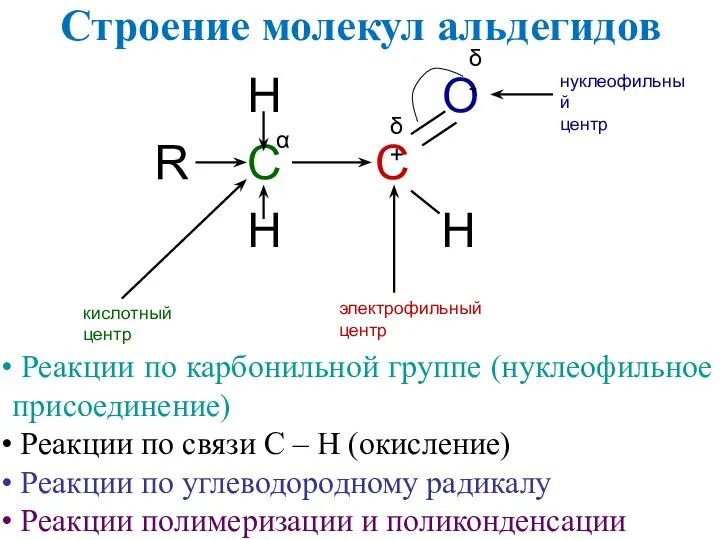
- 2. Строение молекул альдегидов H O R C C H H нуклеофильный центр кислотный центр Реакции по
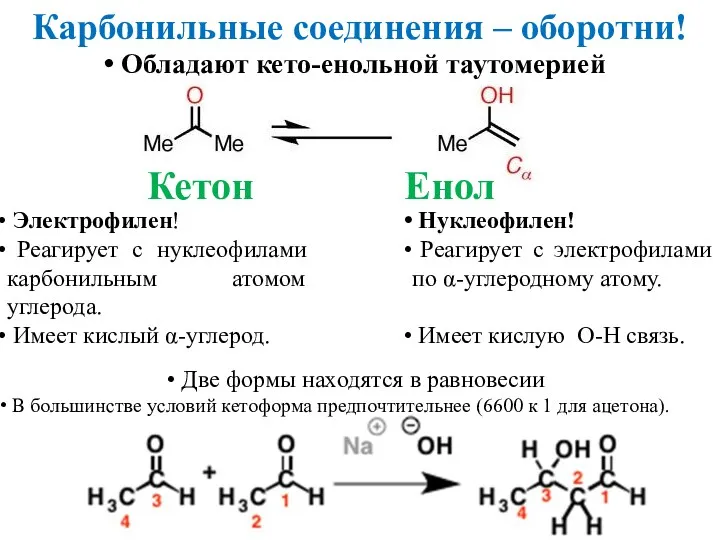
- 3. Карбонильные соединения – оборотни! Обладают кето-енольной таутомерией Кетон Енол Электрофилен! Реагирует с нуклеофилами карбонильным атомом углерода.
- 4. Реакции восстановления Образование спиртов Образование алканов Реакции окисления Реакции нуклеофильного присоединения Присоединение HCN с образование циангидринов
- 5. Это самое важное, что вообще есть в органической химии. В значительной мере органическая химия – это
- 6. На альдегидах и кетонах карбонильная группа не заканчивается. Карбоновые кислоты и их производные – еще несколько
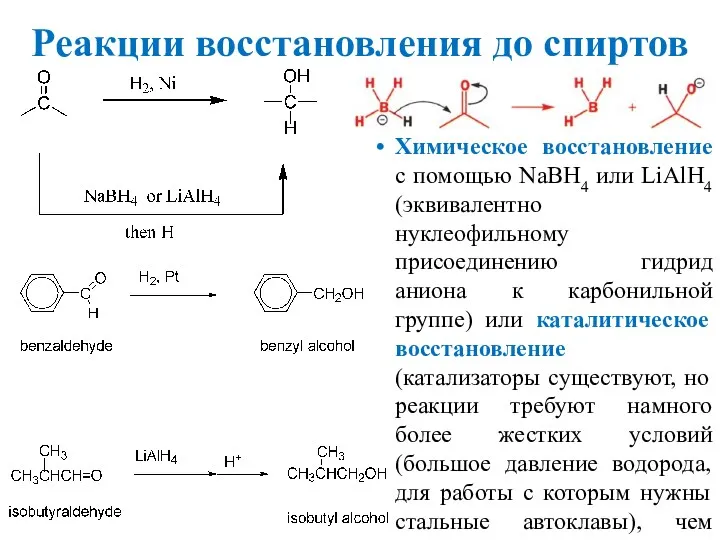
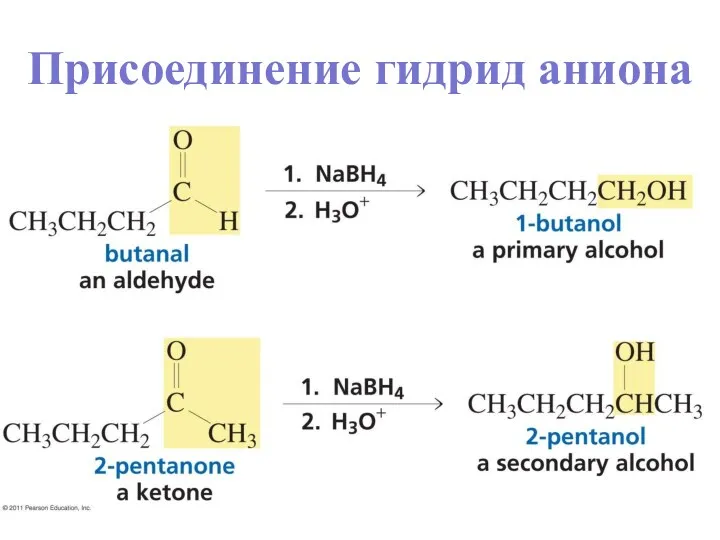
- 7. Реакции восстановления до спиртов Химическое восстановление с помощью NaBH4 или LiAlH4 (эквивалентно нуклеофильному присоединению гидрид аниона
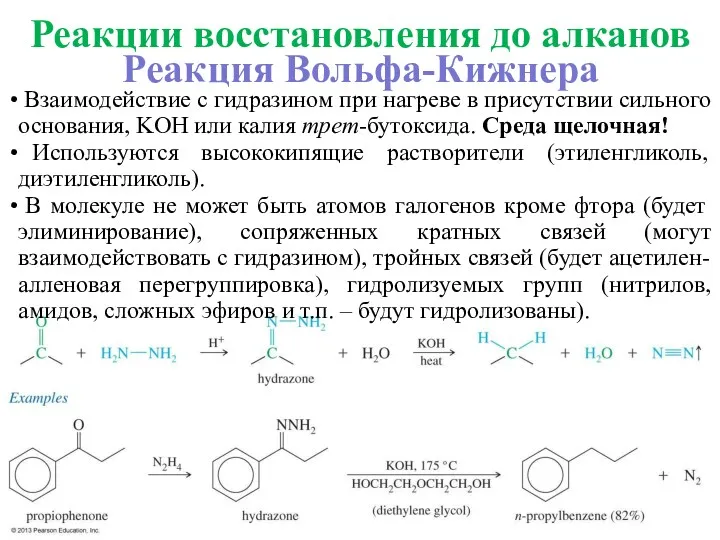
- 8. Реакция Вольфа-Кижнера Взаимодействие с гидразином при нагреве в присутствии сильного основания, KOH или калия трет-бутоксида. Среда
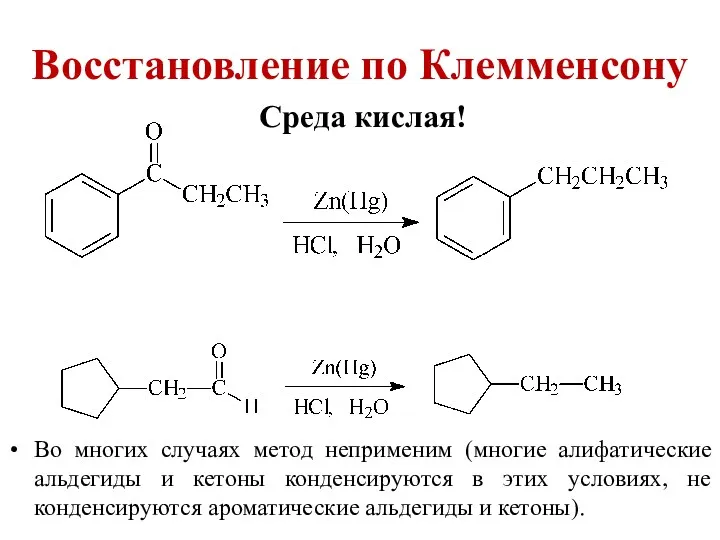
- 9. Восстановление по Клемменсону Среда кислая! Во многих случаях метод неприменим (многие алифатические альдегиды и кетоны конденсируются
- 10. CH3CH2CH2CH=O + KMnO4, etc. ? CH3CH2CH2COOH карбоновая кислота CH3CH2CH2CH=O + Ag+ ? CH3CH2CH2COO- + Ag Тест
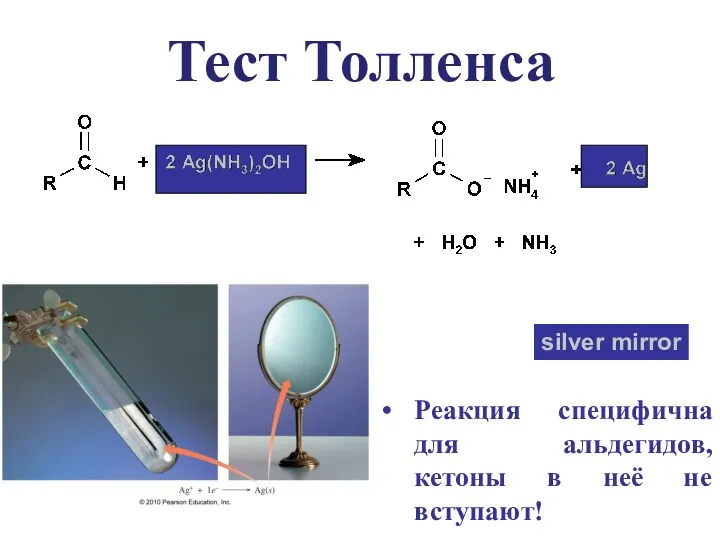
- 11. Тест Толленса silver mirror Реакция специфична для альдегидов, кетоны в неё не вступают!
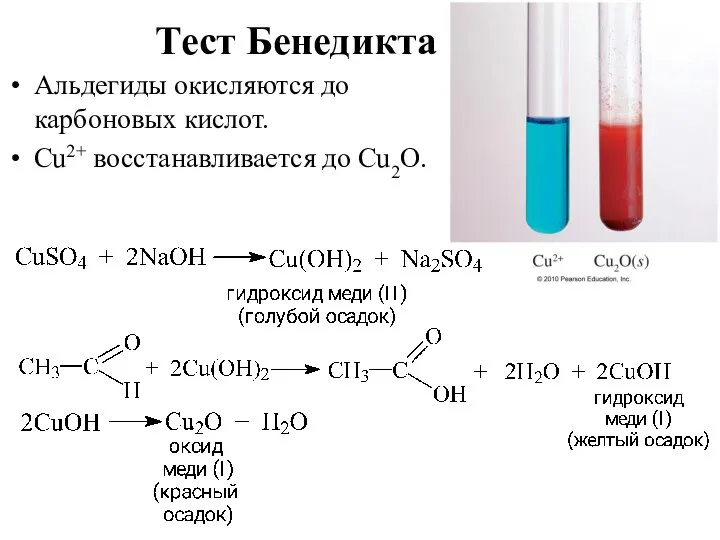
- 12. Тест Бенедикта Альдегиды окисляются до карбоновых кислот. Cu2+ восстанавливается до Cu2O.
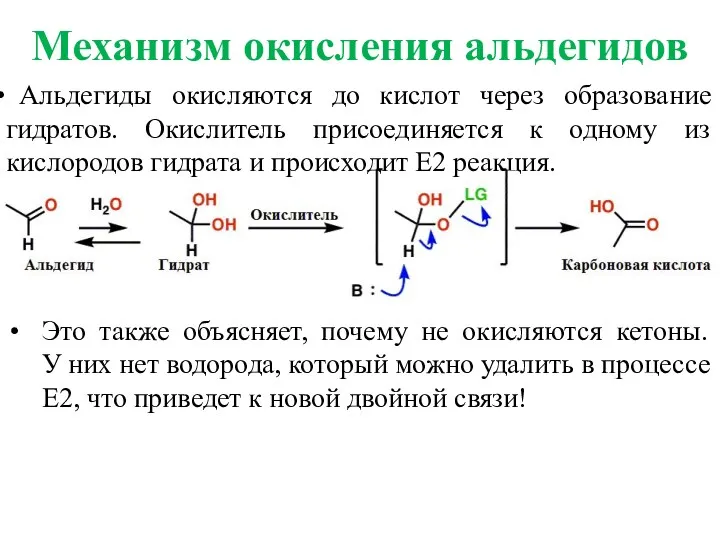
- 13. Механизм окисления альдегидов Альдегиды окисляются до кислот через образование гидратов. Окислитель присоединяется к одному из кислородов
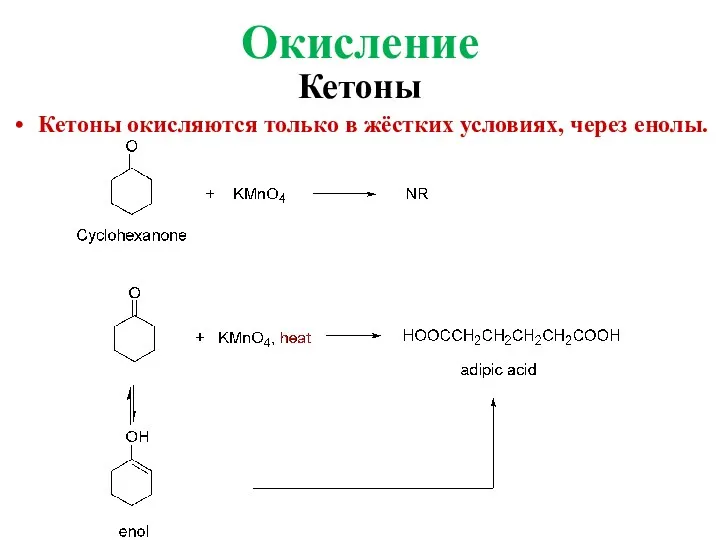
- 14. Кетоны окисляются только в жёстких условиях, через енолы. Окисление Кетоны
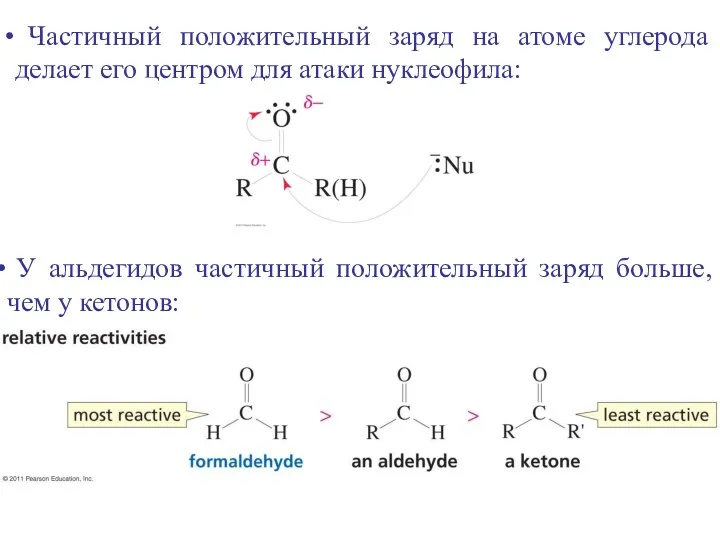
- 15. У альдегидов частичный положительный заряд больше, чем у кетонов: Частичный положительный заряд на атоме углерода делает
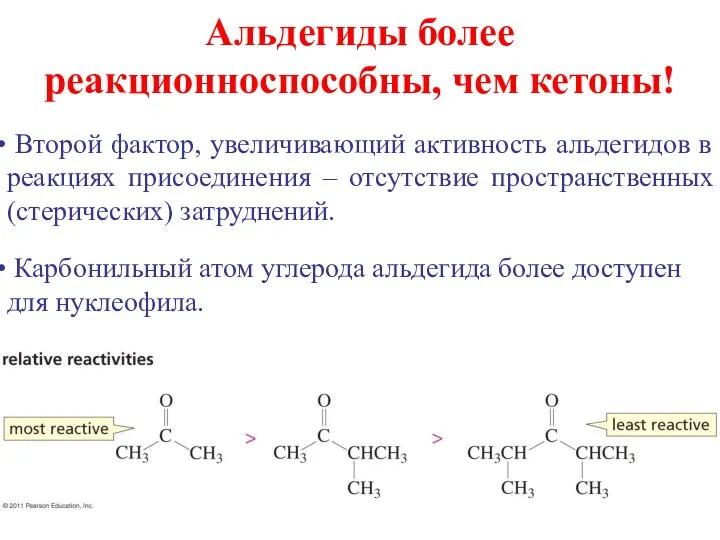
- 16. Карбонильный атом углерода альдегида более доступен для нуклеофила. Второй фактор, увеличивающий активность альдегидов в реакциях присоединения
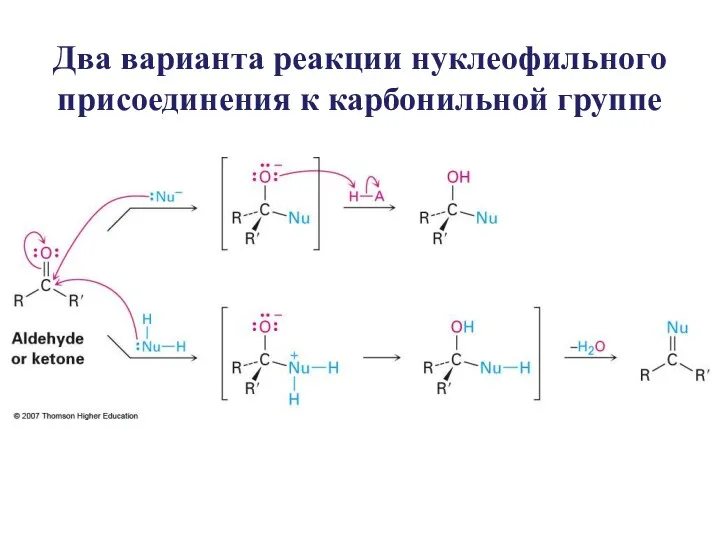
- 17. Два варианта реакции нуклеофильного присоединения к карбонильной группе
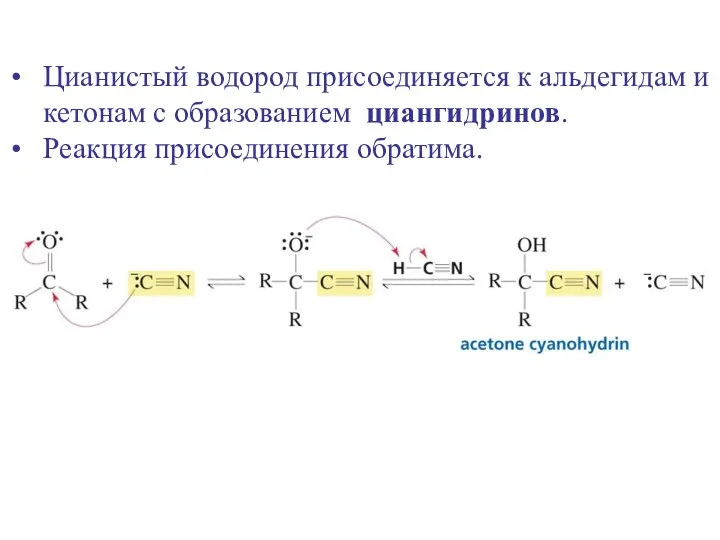
- 18. Цианистый водород присоединяется к альдегидам и кетонам с образованием циангидринов. Реакция присоединения обратима.
- 19. В инструкциях давних лет (1907, 1941 г) рекомендуется (Л. Гаттерманом) в лаборатории курить во время работ
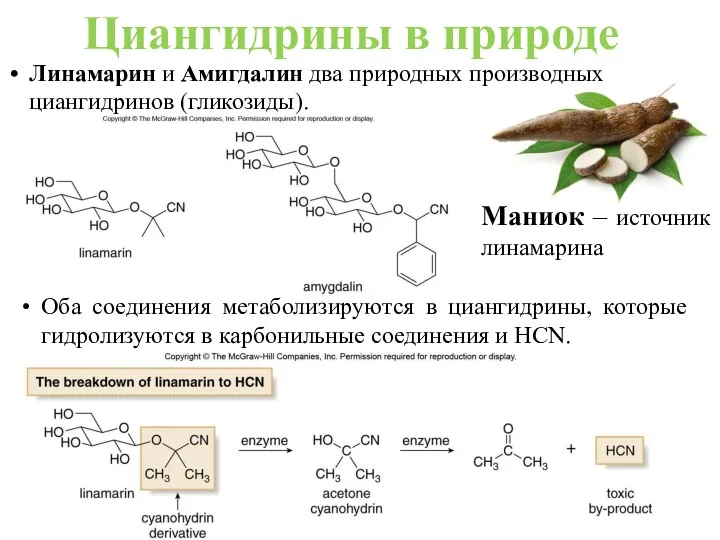
- 20. Линамарин и Амигдалин два природных производных циангидринов (гликозиды). Оба соединения метаболизируются в циангидрины, которые гидролизуются в
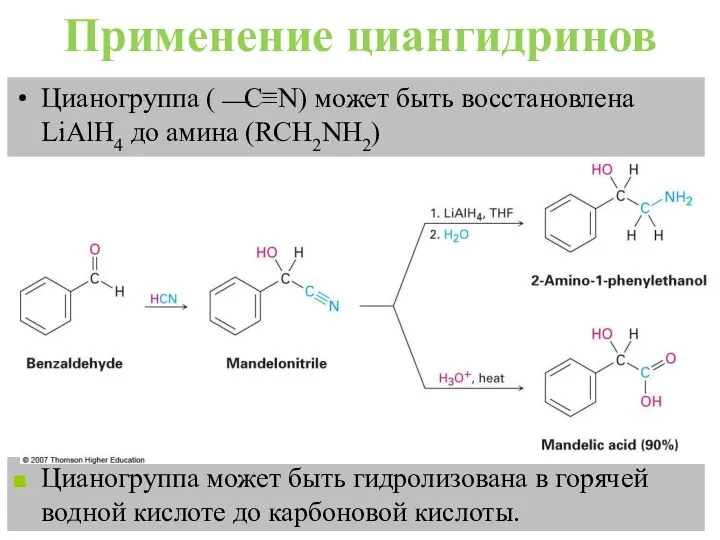
- 21. Применение циангидринов Цианогруппа (⎯C≡N) может быть восстановлена LiAlH4 до амина (RCH2NH2) Цианогруппа может быть гидролизована в
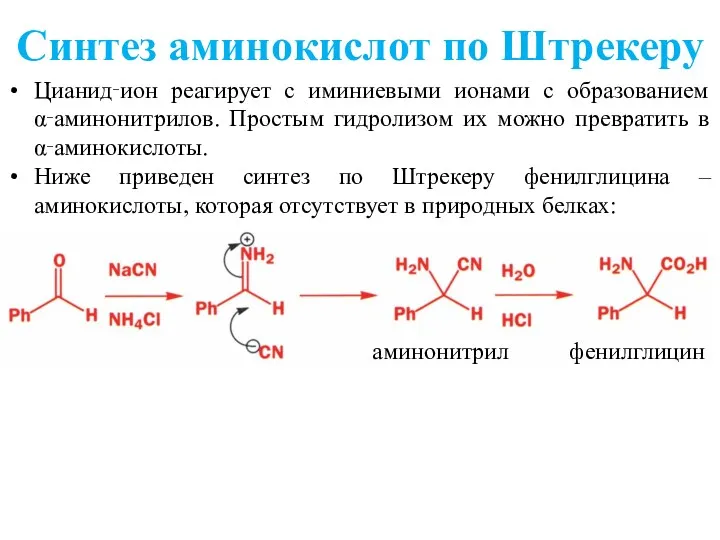
- 22. Синтез аминокислот по Штрекеру Цианид‑ион реагирует с иминиевыми ионами с образованием α‑аминонитрилов. Простым гидролизом их можно
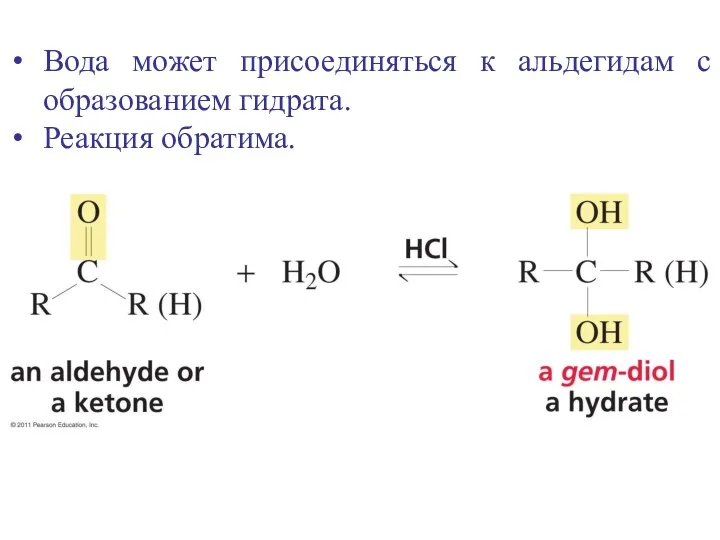
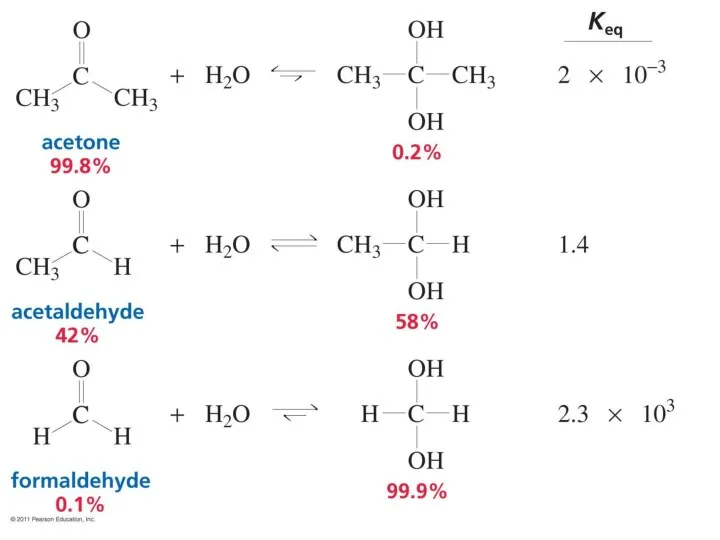
- 23. Вода может присоединяться к альдегидам с образованием гидрата. Реакция обратима.
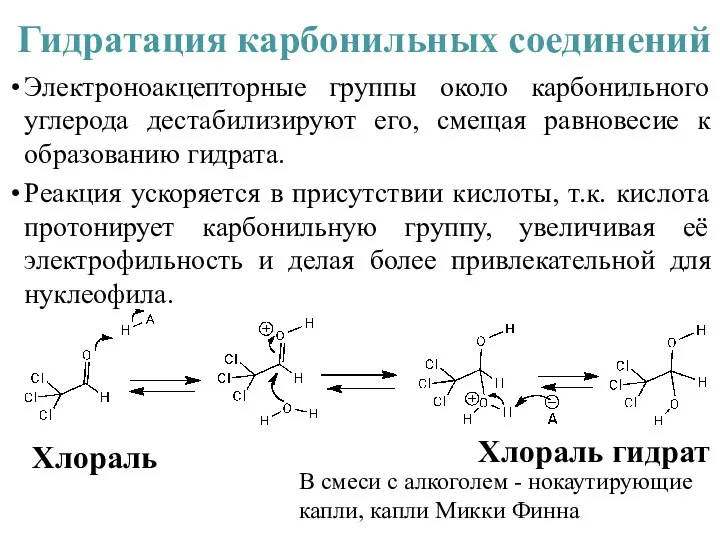
- 25. Электроноакцепторные группы около карбонильного углерода дестабилизируют его, смещая равновесие к образованию гидрата. Реакция ускоряется в присутствии
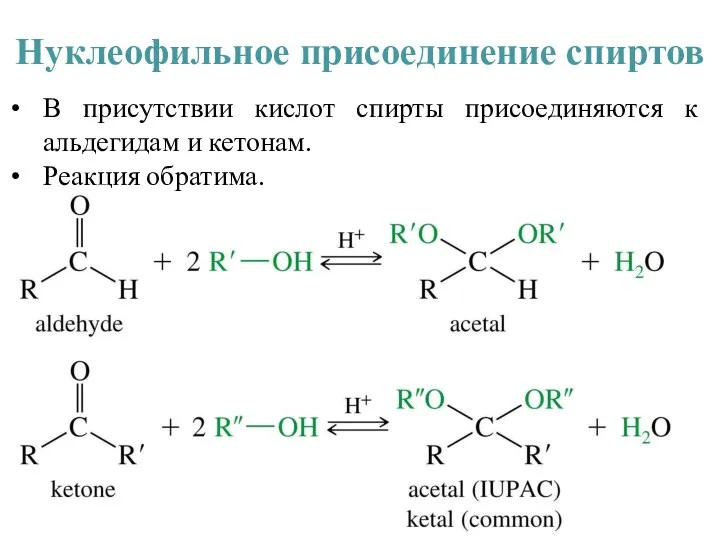
- 26. Нуклеофильное присоединение спиртов В присутствии кислот спирты присоединяются к альдегидам и кетонам. Реакция обратима.
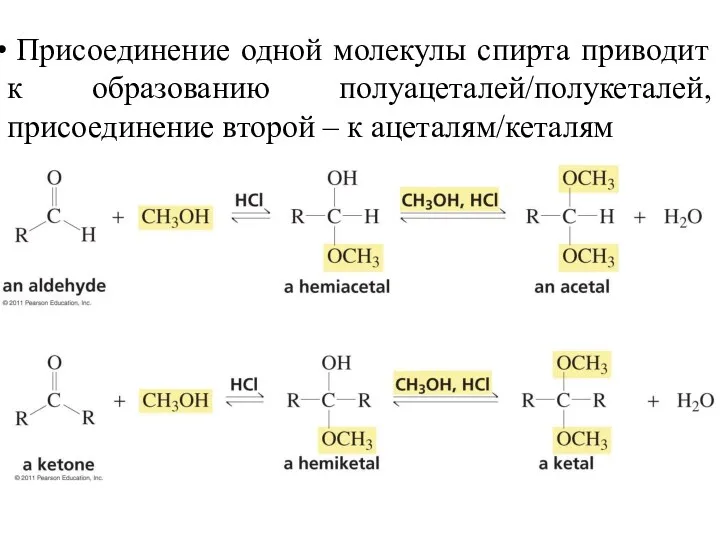
- 27. Присоединение одной молекулы спирта приводит к образованию полуацеталей/полукеталей, присоединение второй – к ацеталям/кеталям
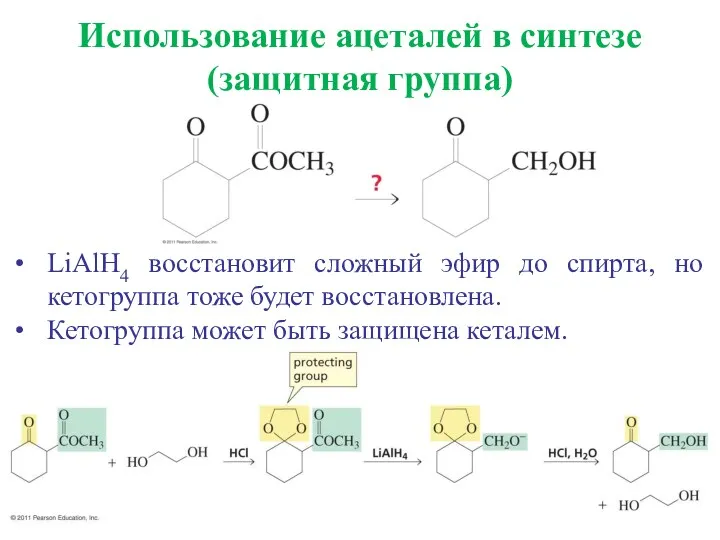
- 28. Использование ацеталей в синтезе (защитная группа) LiAlH4 восстановит сложный эфир до спирта, но кетогруппа тоже будет
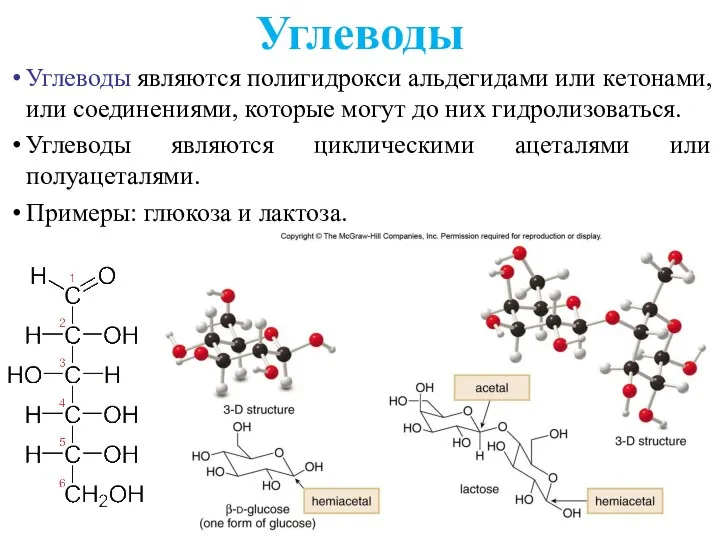
- 29. Углеводы являются полигидрокси альдегидами или кетонами, или соединениями, которые могут до них гидролизоваться. Углеводы являются циклическими
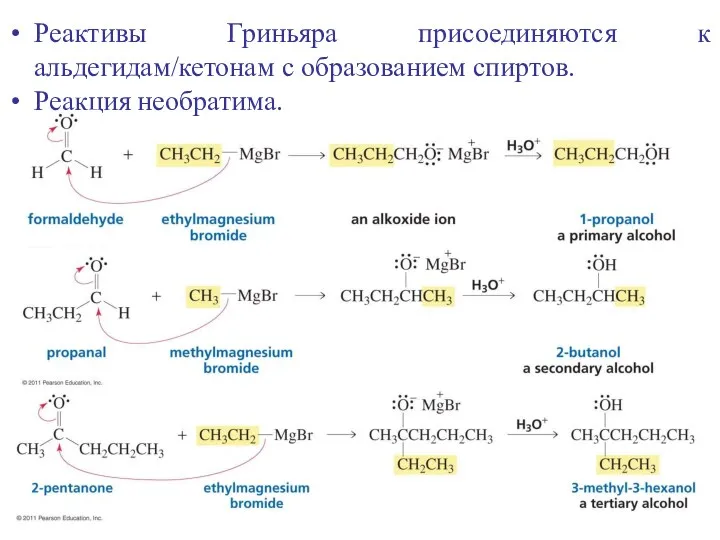
- 30. Реактивы Гриньяра присоединяются к альдегидам/кетонам с образованием спиртов. Реакция необратима.
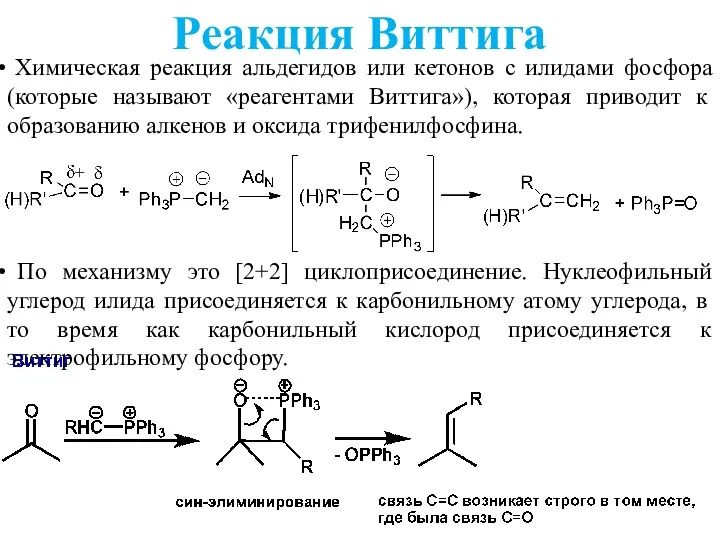
- 31. Реакция Виттига Химическая реакция альдегидов или кетонов с илидами фосфора (которые называют «реагентами Виттига»), которая приводит
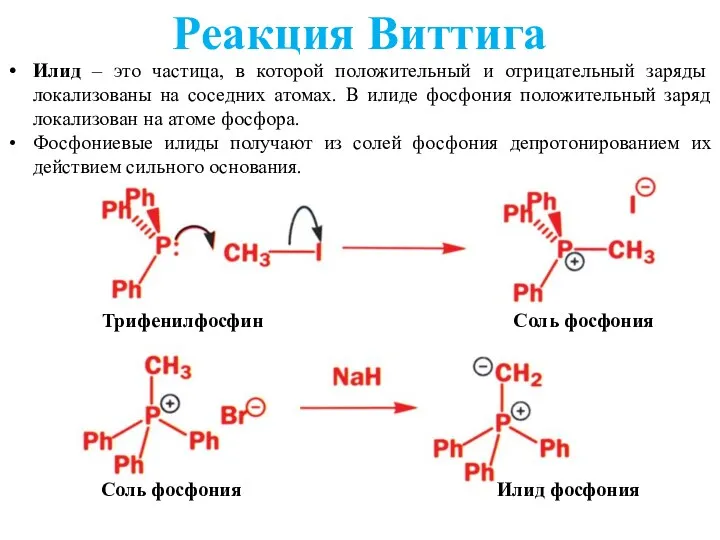
- 32. Реакция Виттига Илид – это частица, в которой положительный и отрицательный заряды локализованы на соседних атомах.
- 33. Реакция Виттига Реакция региоселективна – образуется только один алкен. Хороший путь получения терминальных алкенов – другими
- 34. Присоединение гидрид аниона Превращает C=O в CH-OH. LiAlH4 и NaBH4 служат донорами гидрид аниона. Протонирование после
- 35. Присоединение гидрид аниона
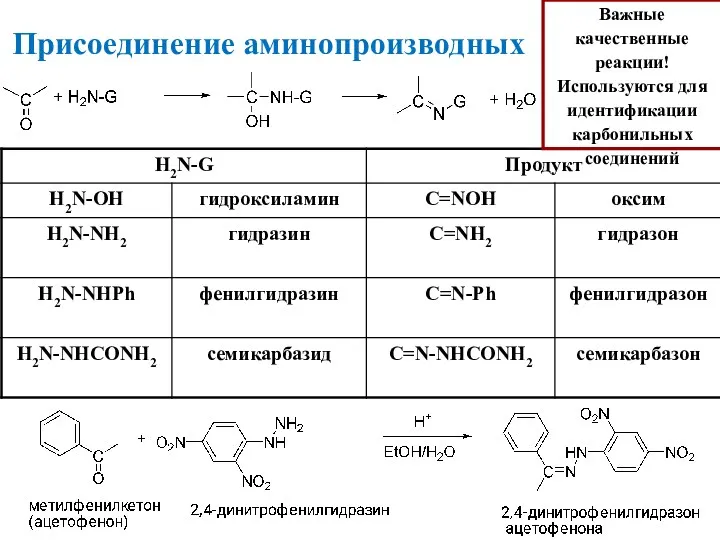
- 36. Присоединение аминопроизводных Важные качественные реакции! Используются для идентификации карбонильных соединений
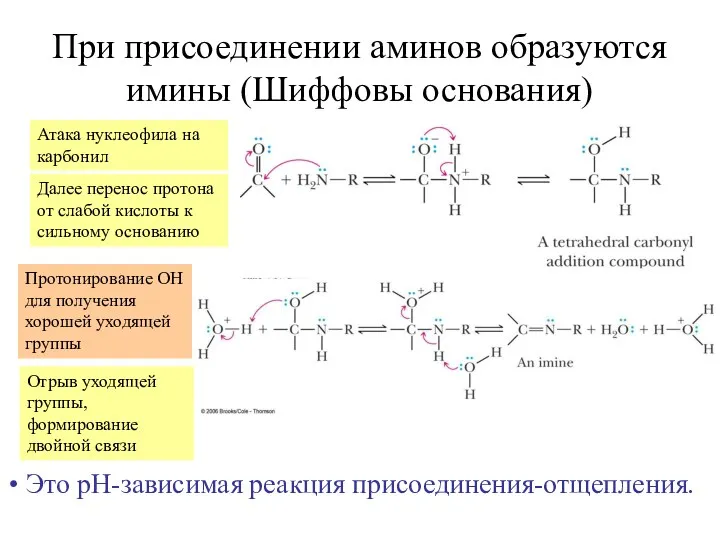
- 37. При присоединении аминов образуются имины (Шиффовы основания) Атака нуклеофила на карбонил Далее перенос протона от слабой
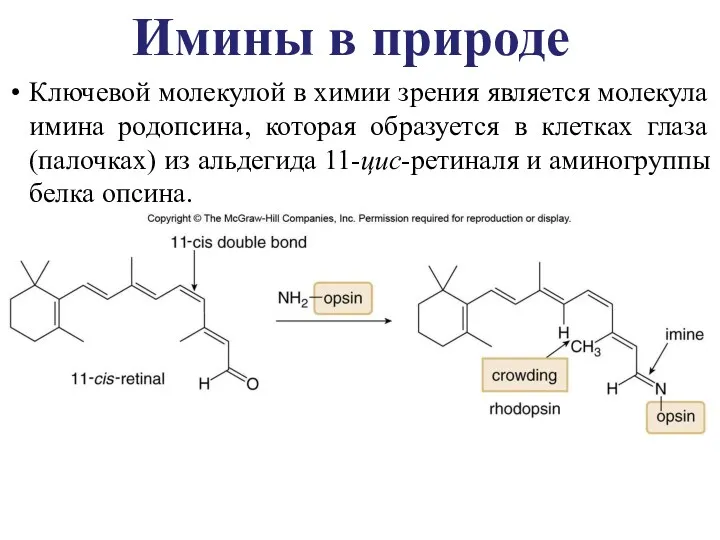
- 38. Ключевой молекулой в химии зрения является молекула имина родопсина, которая образуется в клетках глаза (палочках) из
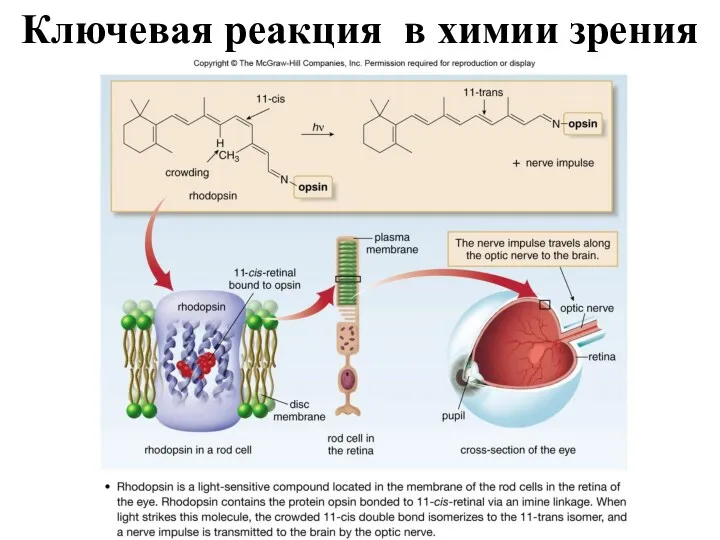
- 39. Ключевая реакция в химии зрения
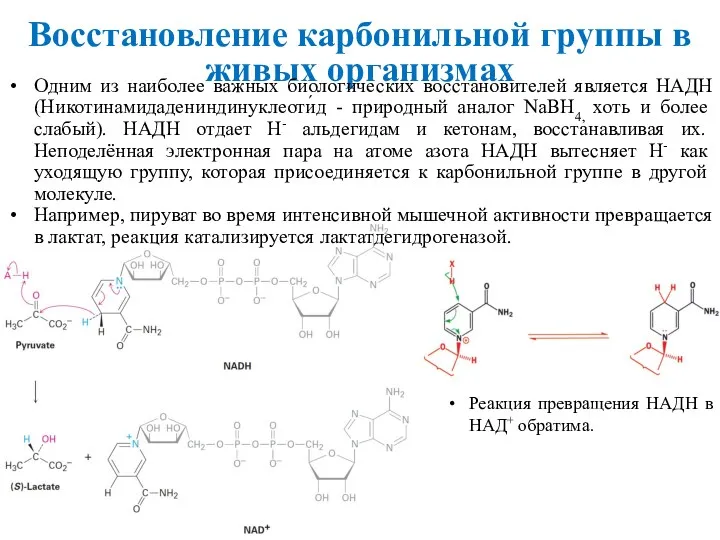
- 40. Восстановление карбонильной группы в живых организмах Одним из наиболее важных биологических восстановителей является НАДН (Никотинамидадениндинуклеоти́д -
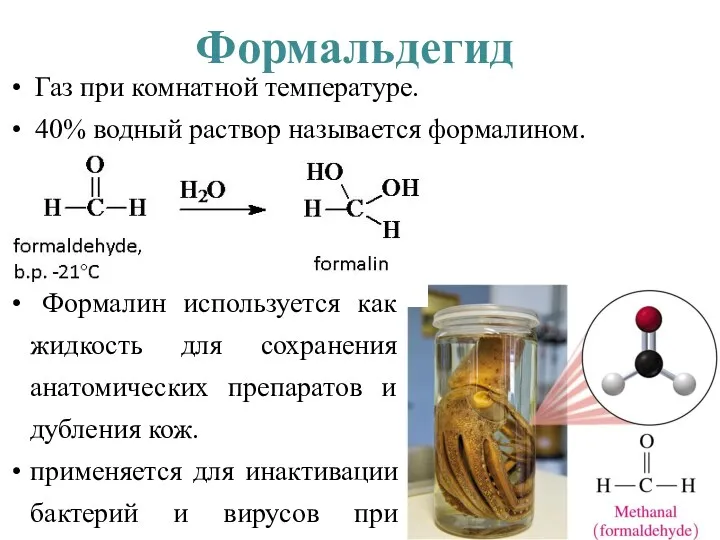
- 41. Формальдегид Газ при комнатной температуре. 40% водный раствор называется формалином. Формалин используется как жидкость для сохранения
- 42. Дым, образующийся при сгорании угля (дерева) содержит формальдегид и вызывает слезы. Формальдегид – это лакриматор.
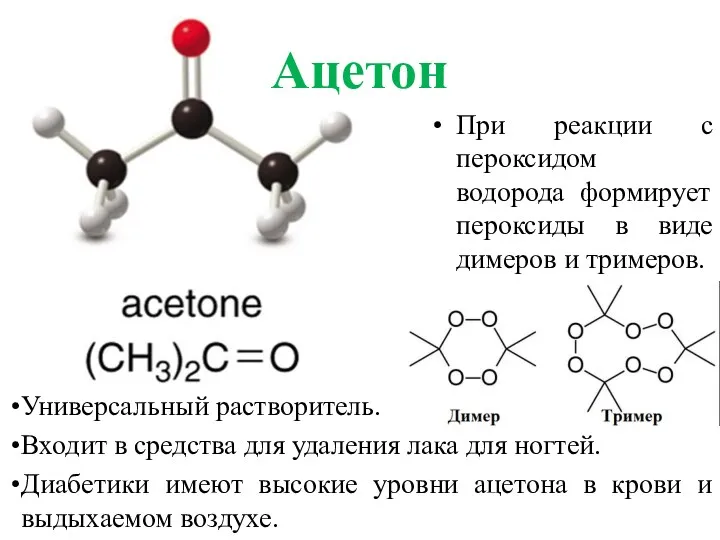
- 43. Универсальный растворитель. Входит в средства для удаления лака для ногтей. Диабетики имеют высокие уровни ацетона в
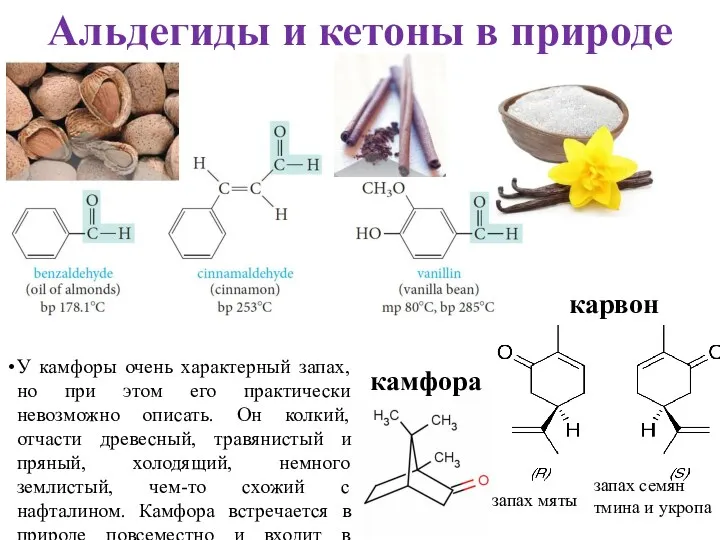
- 44. Альдегиды и кетоны в природе запах семян тмина и укропа запах мяты карвон камфора У камфоры
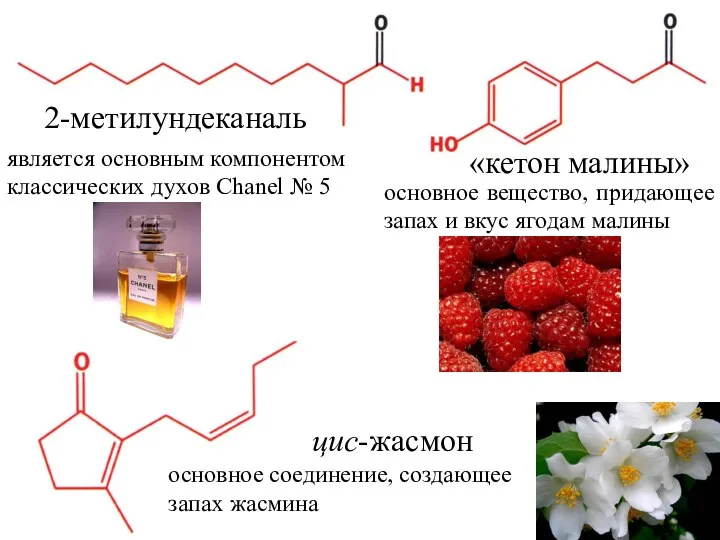
- 45. цис-жасмон основное соединение, создающее запах жасмина является основным компонентом классических духов Chanel № 5 2-метилундеканаль «кетон
- 46. Пигменты пситтакофульвины отвечают за ярко-красный, оранжевый и желтый цвета, характерные для попугаев. Предполагается, что пситтакофульвины ферментативно
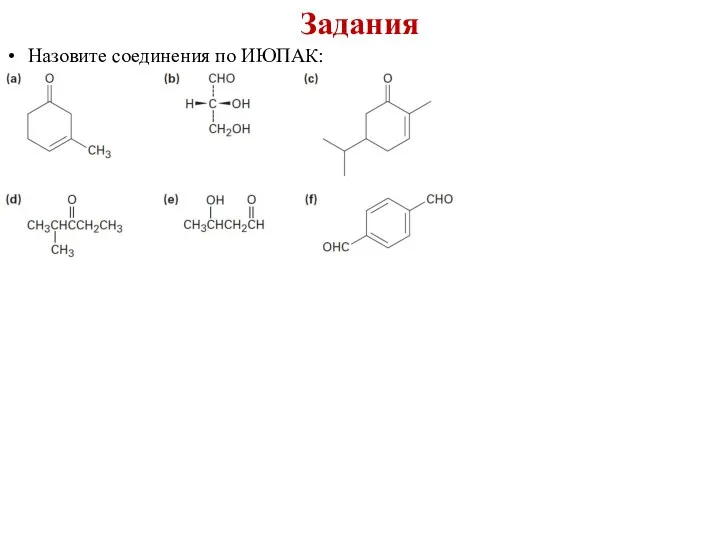
- 47. Задания Назовите соединения по ИЮПАК:
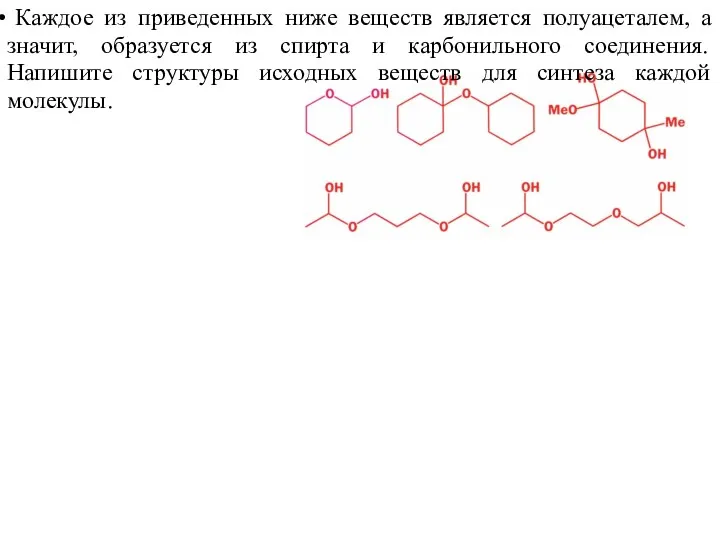
- 48. Каждое из приведенных ниже веществ является полуацеталем, а значит, образуется из спирта и карбонильного соединения. Напишите
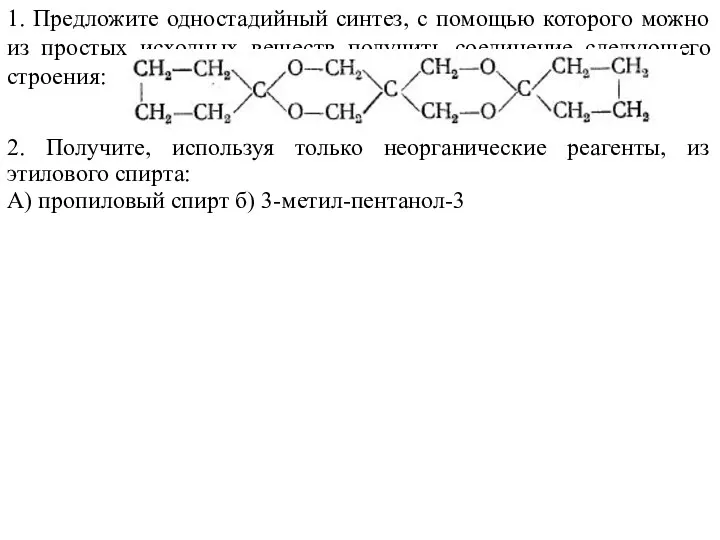
- 49. 1. Предложите одностадийный синтез, с помощью которого можно из простых исходных веществ получить соединение следующего строения:
- 50. Какой продукт должен образовываться в приведенной ниже реакции?
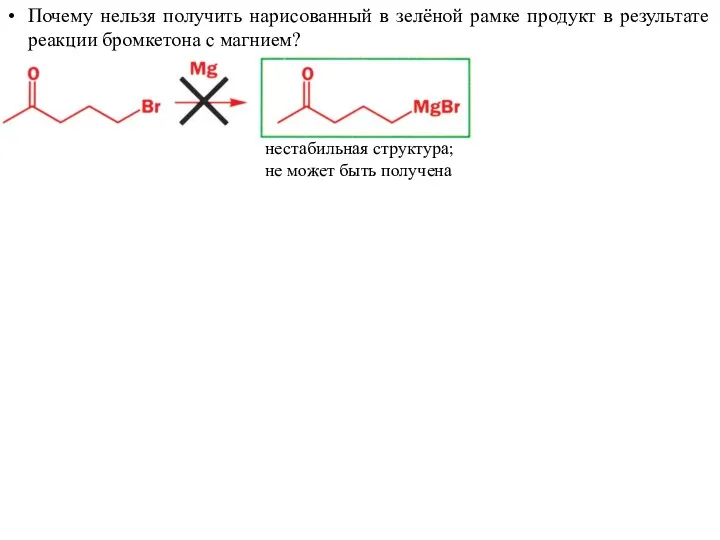
- 51. нестабильная структура; не может быть получена Почему нельзя получить нарисованный в зелёной рамке продукт в результате
- 52. Для синтеза риопростила – препарата, используемого для лечения гастрита, – требуется этот спирт. Предложите возможные методы
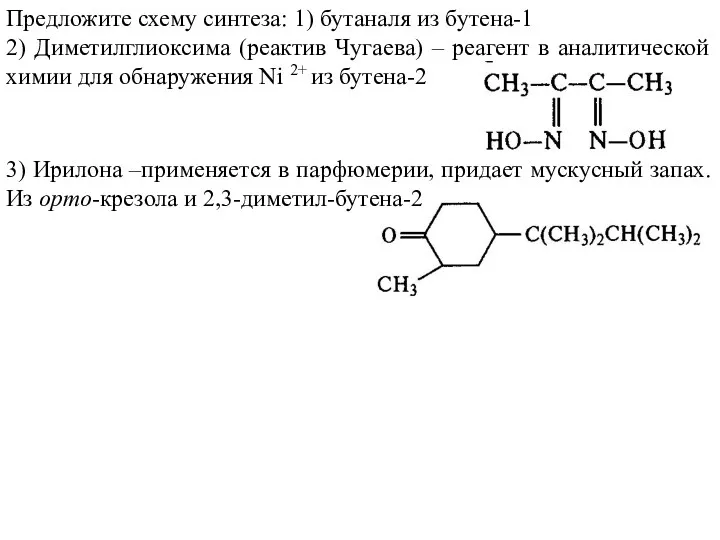
- 53. Предложите схему синтеза: 1) бутаналя из бутена-1 2) Диметилглиоксима (реактив Чугаева) – реагент в аналитической химии
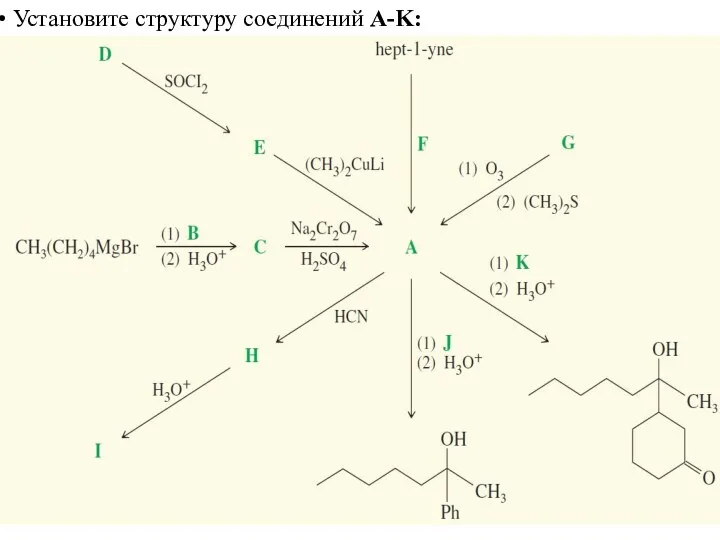
- 54. Установите структуру соединений A-K:
- 55. Расшифруйте схему превращений:
- 56. Вещество Х состава С5Н10О2 обесцвечивает горячий подкисленный раствор перманганата калия, при длительном кипячении превращаясь в С5Н8О4,
- 57. Вещество Х состава С8Н7ОСl обесцвечивает горячий подкисленный раствор перманганата калия и превращается во фталевую (1,2-бензолдикарбоновую кислоту).
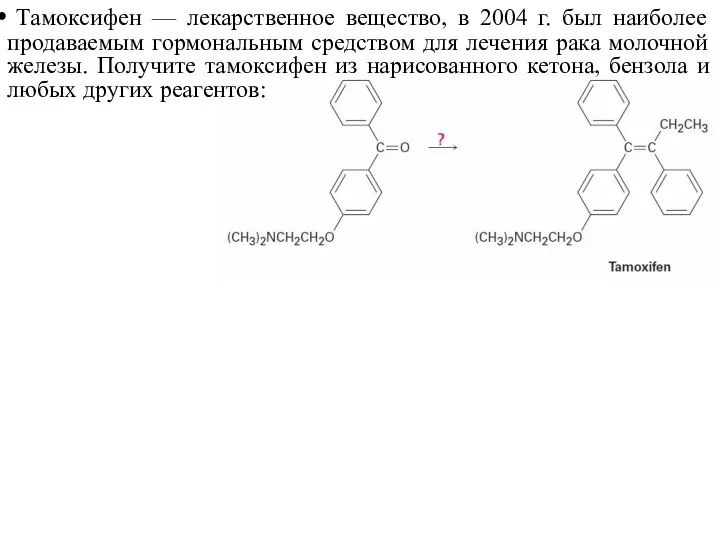
- 58. Тамоксифен — лекарственное вещество, в 2004 г. был наиболее продаваемым гормональным средством для лечения рака молочной
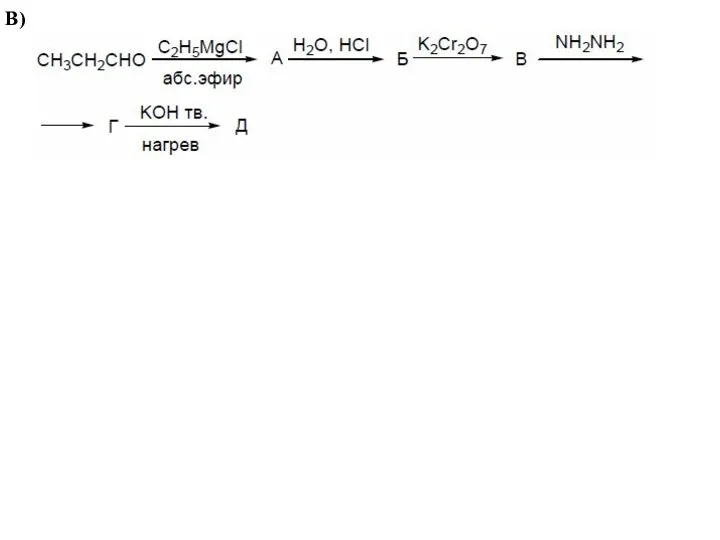
- 59. Осуществите цепочки превращений: А) Б)
- 60. В)
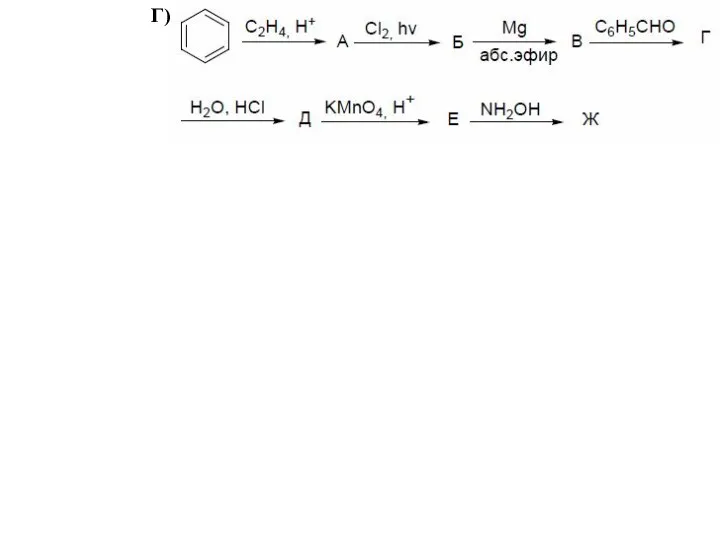
- 61. Г)
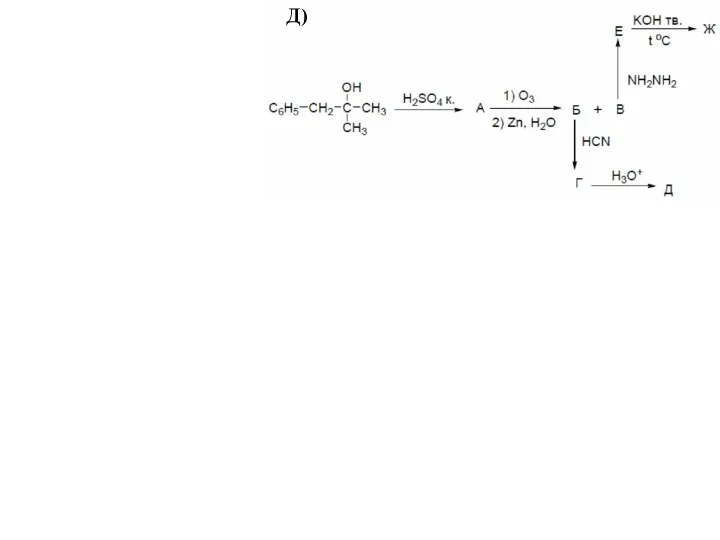
- 62. Д)
- 63. Напишите структурную формула вещества С9H10O, которое дает реакцию серебряного зеркала, реагирует с фенилгидразином, при окислении превращается
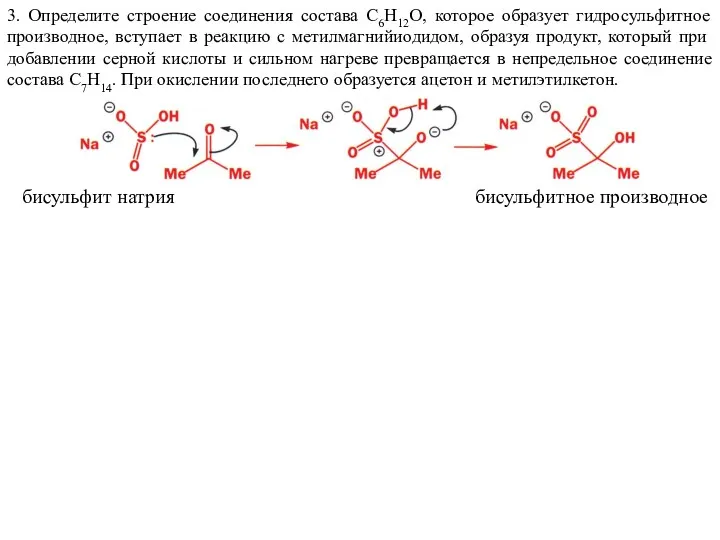
- 64. 3. Определите строение соединения состава C6H12O, которое образует гидросульфитное производное, вступает в реакцию с метилмагнийиодидом, образуя
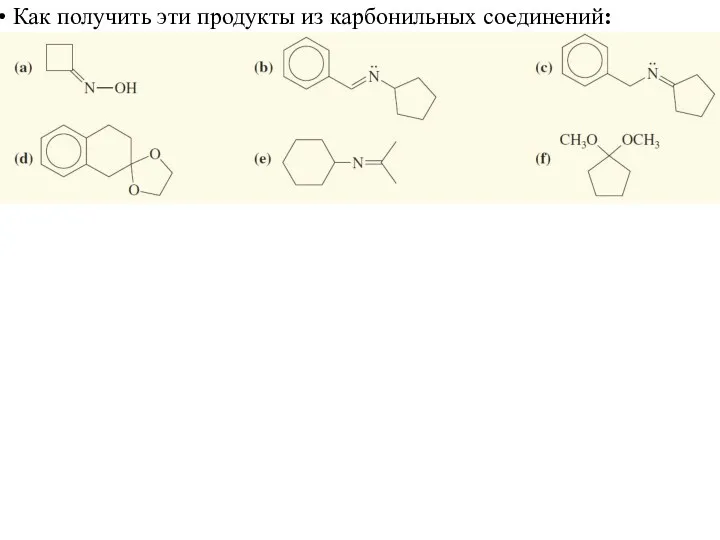
- 65. Как получить эти продукты из карбонильных соединений:
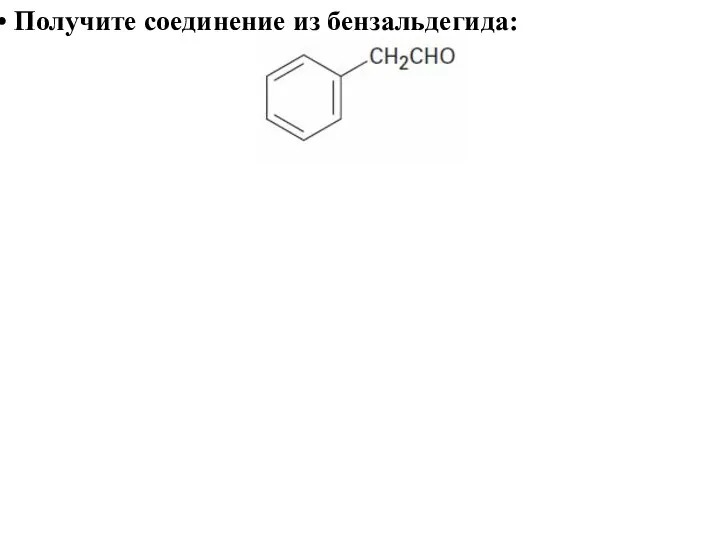
- 66. Получите соединение из бензальдегида:
- 67. Как синтезировать октан-2-он из каждого из следующих соединений: a) гептаналь; b) окт-1-ин; c) 2,3-диметилнон-2-ен; d) октан-2-ол.
- 68. Как осуществить следующие превращения: a) бензол в н-бутилбензол; b) бензонитрил в пропиофенон; c) бензол в пара-метоксибензальдегид.
- 69. 1) Метилциклопентилового эфира из циклопентанона и метанола 2) 4-нитробензальдегида из бензола Предложите схему синтеза:
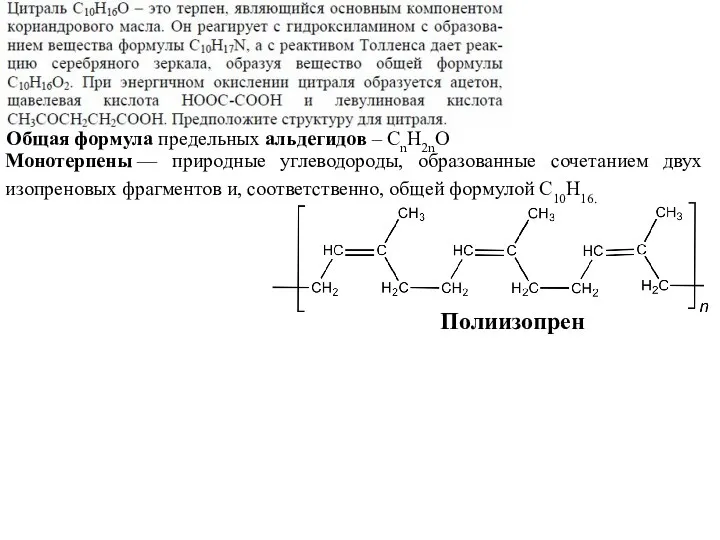
- 70. Монотерпены — природные углеводороды, образованные сочетанием двух изопреновых фрагментов и, соответственно, общей формулой C10H16. Полиизопрен Общая
- 72. Скачать презентацию



















 Углероды. Строение и свойства атомов
Углероды. Строение и свойства атомов Полимеры
Полимеры Кристаллическая решетка
Кристаллическая решетка Химические элементы As, Sb, Bi
Химические элементы As, Sb, Bi Готовимся к экзамену по химии. 9 класс
Готовимся к экзамену по химии. 9 класс В мире химии. Периодический закон и ПСХЭ
В мире химии. Периодический закон и ПСХЭ Сплави алюмінію. Характеристики та застосування
Сплави алюмінію. Характеристики та застосування Углеводы (сахариды)
Углеводы (сахариды) Применение здм к кислотно-основным равновесиям и их роль в аналитической химии
Применение здм к кислотно-основным равновесиям и их роль в аналитической химии Важнейшие оксиды в природе и жизни человека
Важнейшие оксиды в природе и жизни человека Разбираем задания
Разбираем задания Чистые вещества и смеси
Чистые вещества и смеси Ароматические углеводороды. Процессы производства. Направления использования
Ароматические углеводороды. Процессы производства. Направления использования Биологически важные окислительно-восстановительные реакции органических соединений
Биологически важные окислительно-восстановительные реакции органических соединений Химия биогенных элементов p -блока
Химия биогенных элементов p -блока Виды топлива
Виды топлива Кондуктометрия. Кондуктометрия әдісі. Электрохимиялық әдістер
Кондуктометрия. Кондуктометрия әдісі. Электрохимиялық әдістер Пластмаси. Класифікація пластмас
Пластмаси. Класифікація пластмас Синтетические моющие средства
Синтетические моющие средства Воздух и его состав
Воздух и его состав Коррозия металлов
Коррозия металлов Щелочные металлы
Щелочные металлы Использование информационных технологий при обучении химии
Использование информационных технологий при обучении химии Неметаллы
Неметаллы Массовая доля элемента в веществе
Массовая доля элемента в веществе Признаки химических реакций
Признаки химических реакций Амины. Анилин
Амины. Анилин Процессы и аппараты химических производств
Процессы и аппараты химических производств