Содержание
- 2. Термин «информационные технологии» подразумевает использование компьютеров как новых средств подготовки, диагностики, контроля и обучения предметам. Они
- 3. Применение компьютера при обучении химии в школе целесообразно в тех случаях, когда обычных средств обучения уже
- 4. Медиа- лекции: «Углерод. Аллотропия.» (9 класс) «Природные источники углеводородов» (10 класс) «Белки, их строение и свойства»
- 5. Уроки комбинированного типа: «Алюминий и его соединения»(9 класс) «Многоатомные спирты» (10 класс) «Качественные реакции в органической
- 6. NH3 + H2O = NH4+ + OH - HF + H2O = F - + H30
- 7. 1. Катион – это: а) ион меди; б) атом серы; в) ион серы; г) атом меди.
- 8. 1. Катион – это: а) ион меди; б) атом серы; в) ион серы; г) атом меди.
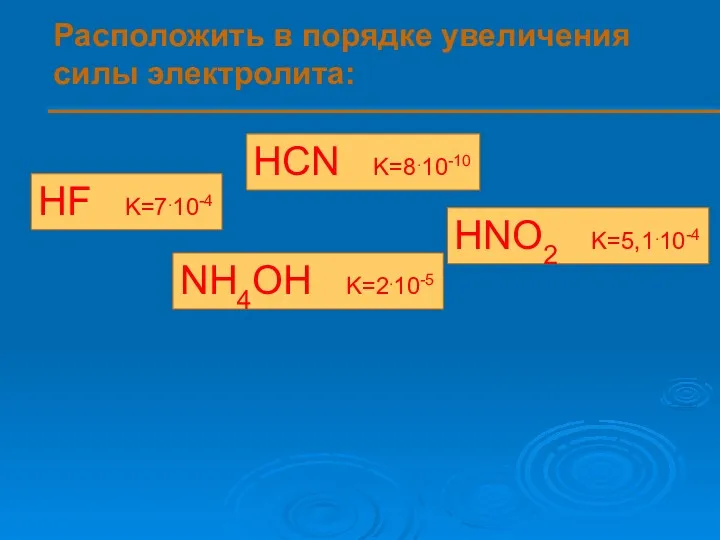
- 9. Расположить в порядке увеличения силы электролита: HF K=7.10-4 HCN K=8.10-10 HNO2 K=5,1.10-4 NH4OH K=2.10-5
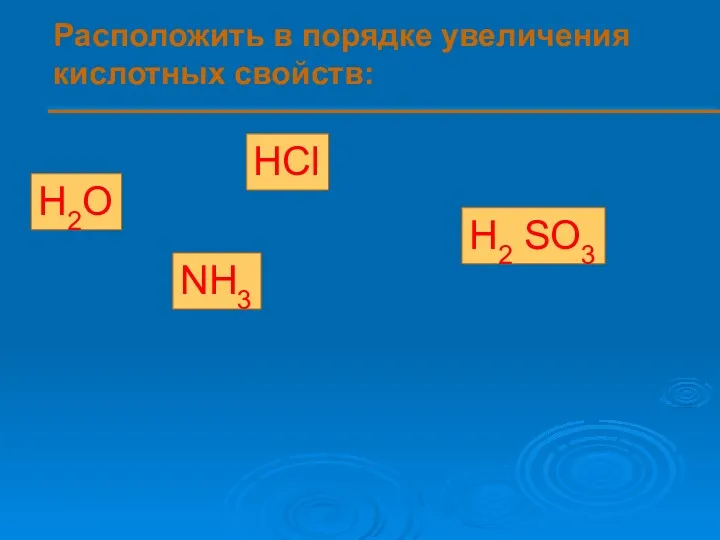
- 10. Расположить в порядке увеличения кислотных свойств: H2O HCl H2 SO3 NH3
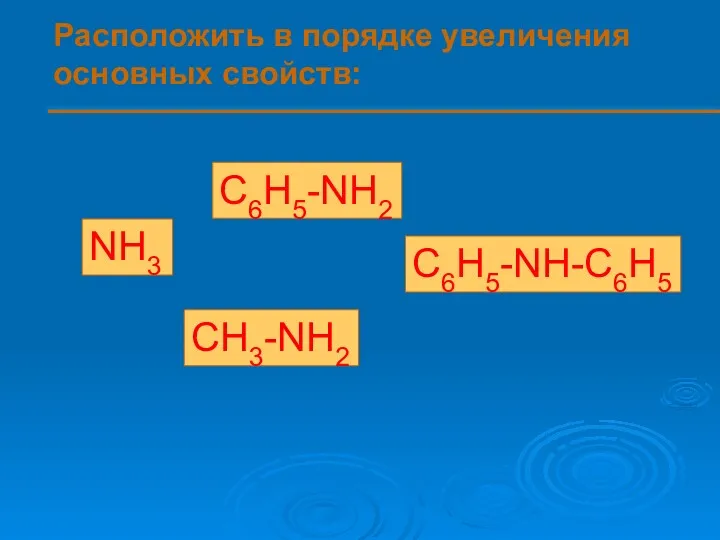
- 11. Расположить в порядке увеличения основных свойств: NH3 C6H5-NH2 C6H5-NH-C6H5 CH3-NH2
- 12. Укажи, допущены ли ошибки в тексте: 1. На процесс диссоциации влияет растворение или расплавление вещества. 2.
- 13. Укажи, допущены ли ошибки в тексте: 1. На процесс диссоциации влияет растворение или расплавление вещества. 2.
- 15. Скачать презентацию









 Теория сплавов
Теория сплавов Биосенсорные системы
Биосенсорные системы Соли. Классификация
Соли. Классификация Основи. Склад, назви, класифікація, використання
Основи. Склад, назви, класифікація, використання Водород. Общая характеристика, получение, свойства
Водород. Общая характеристика, получение, свойства Арены. Бензол и его гомологи. Химия. 10 класс
Арены. Бензол и его гомологи. Химия. 10 класс Расчеты по химическим уравнениям. Алгоритм решения расчетных задач
Расчеты по химическим уравнениям. Алгоритм решения расчетных задач Химическая взрывчатка
Химическая взрывчатка Получение галогенов. Биологическое значение и применение галогенов и их соединений
Получение галогенов. Биологическое значение и применение галогенов и их соединений Тағамдық қоспалардың функционалдық жүктелуі және олардың сипаттамасы
Тағамдық қоспалардың функционалдық жүктелуі және олардың сипаттамасы Тест по неорганической химии
Тест по неорганической химии Производство серной кислоты контактным способом
Производство серной кислоты контактным способом Белки. Содержание белков в различных тканях
Белки. Содержание белков в различных тканях Водород. Химические свойства
Водород. Химические свойства Хлор
Хлор Пропилен-алкены(пропен)
Пропилен-алкены(пропен) Аминокислоты. Пептиды. Белки
Аминокислоты. Пептиды. Белки Объемная доля газа в смеси. (Урок 16. 7 класс)
Объемная доля газа в смеси. (Урок 16. 7 класс) Современные тенденции развития химии
Современные тенденции развития химии Периодический закон и периодическая система химических элементов Д.И. Менделеева
Периодический закон и периодическая система химических элементов Д.И. Менделеева Незвичайна вода
Незвичайна вода Химия. Викторина
Химия. Викторина Карбоновые кислоты. Свойства карбоновых кислот
Карбоновые кислоты. Свойства карбоновых кислот Соли аммония
Соли аммония Азотная кислота
Азотная кислота Керамические материалы
Керамические материалы Химическая промышленность и химические технологии
Химическая промышленность и химические технологии Задачи
Задачи