Содержание
- 2. Хлор в периодической системе Д. И. Менделеева Порядковый номер 17 Группа 7 Главная подгруппа (А) Подгруппа
- 3. Нахождение Cl в природе В природе хлор встречается только в виде соединений в составе минералов, поскольку
- 4. Нахождение Cl в природе В земной коре хлор - самый распространённый галоген. Содержание хлора в земной
- 5. Получение хлора Впервые хлор получил шведский химик Карл Шееле в 1774 году Для этого в промышленности
- 6. Получение хлора В лабораторных условиях хлор получают из соляной кислоты, действуя на нее сильными окислителями. Чаще
- 7. Физические свойства Хлор при обычных условиях – газ желто-зеленого цвета с резким удушливым запахом, почти в
- 8. Физические свойства Хлор под давлением около 0,6 МПа уже при комнатной температуре превращается в жидкость. В
- 9. Химические свойства Хлор реагирует с простыми веществами со сложными веществами с металлами с водородом с водой
- 10. Взаимодействие хлора с другими элементами I. Взаимодействие хлора с простыми веществами 1. Хлор реагирует почти со
- 11. Взаимодействие хлора с другими элементами II . Взаимодействие хлора со сложными веществами Хлор реагирует с водой.
- 12. Применение хлора
- 14. Скачать презентацию
 Сложные углеводы. Олигосахариды и полисахариды
Сложные углеводы. Олигосахариды и полисахариды Химическая связь. Электроотрицательность и полярность связи
Химическая связь. Электроотрицательность и полярность связи Реакционная способность твердых тел и способы ее регулирования
Реакционная способность твердых тел и способы ее регулирования Дисперсные системы
Дисперсные системы Реакции ионного обмена
Реакции ионного обмена Растворение. Растворы. Физическая теория
Растворение. Растворы. Физическая теория Кристаллы и минералы
Кристаллы и минералы Алюминий и его свойства
Алюминий и его свойства Биологически важные реакции карбонильных соединений. Масс-спектрометрия
Биологически важные реакции карбонильных соединений. Масс-спектрометрия Кислород, его характеристика, получение и свойства
Кислород, его характеристика, получение и свойства Окислительно-восстановительные реакции. (лекция №10)
Окислительно-восстановительные реакции. (лекция №10) Сорбционные методы
Сорбционные методы Основания
Основания Валентные возможности атомов. Степень окисления
Валентные возможности атомов. Степень окисления Химический состав воздуха
Химический состав воздуха Буферные растворы. Граф структуры. Теория электрической диссоциации. Химическое равновесие
Буферные растворы. Граф структуры. Теория электрической диссоциации. Химическое равновесие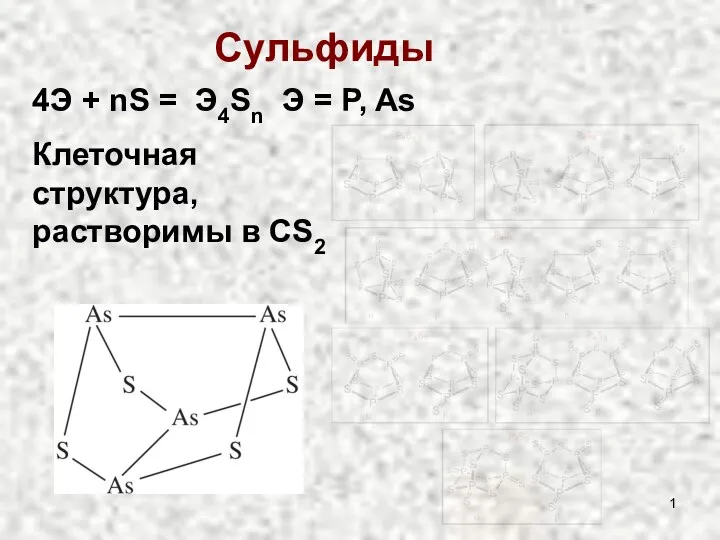 Сульфиды и оксиды
Сульфиды и оксиды Молибденовые сплавы
Молибденовые сплавы Электролиз. Области использования электролиза
Электролиз. Области использования электролиза Кристаллы. Выращивание кристалла
Кристаллы. Выращивание кристалла Диагностические свойства минералов. Занятие 3-4
Диагностические свойства минералов. Занятие 3-4 Показатели химической обстановки при авариях на химически опасных объектах
Показатели химической обстановки при авариях на химически опасных объектах Основные классы органических соединений и их роль в живых организмах
Основные классы органических соединений и их роль в живых организмах Теория строения органических веществ. Предельные углеводороды. 9 класс
Теория строения органических веществ. Предельные углеводороды. 9 класс Элементы химической термодинамики. 1 и 2 законы термодинамики. Химическое равновесие
Элементы химической термодинамики. 1 и 2 законы термодинамики. Химическое равновесие Основные классы неорганических соединений
Основные классы неорганических соединений Галогены. Химические свойства. Применение
Галогены. Химические свойства. Применение Галогены (солеобразующие)
Галогены (солеобразующие)