Содержание
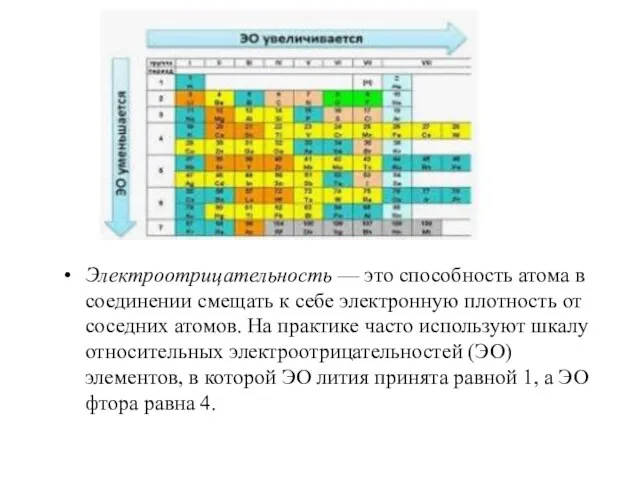
- 2. Электроотрицательность — это способность атома в соединении смещать к себе электронную плотность от соседних атомов. На
- 3. Электроотрицательность служит мерой неметалличности элементов — чем больше значение ЭО, тем сильнее элемент проявляет неметаллические свойства
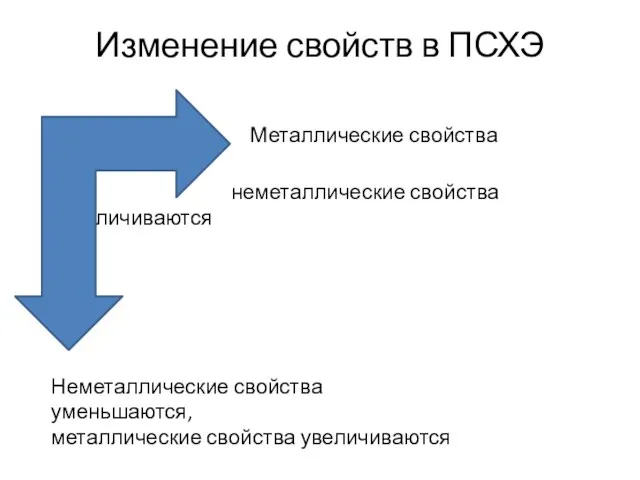
- 4. Изменение свойств в ПСХЭ Металлические свойства уменьшаются, неметаллические свойства увеличиваются Неметаллические свойства уменьшаются, металлические свойства увеличиваются
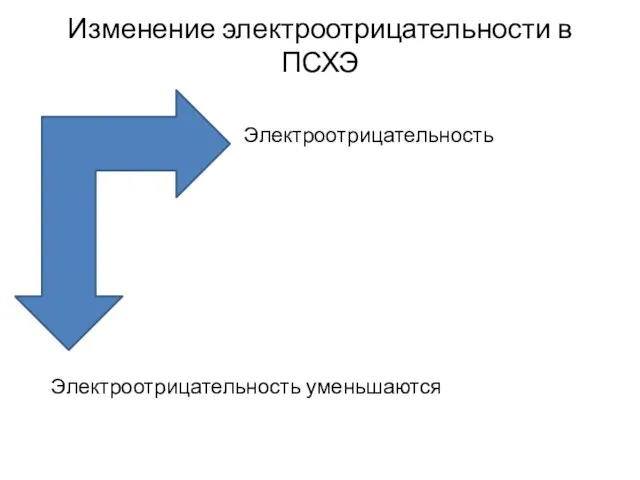
- 5. Изменение электроотрицательности в ПСХЭ Электроотрицательность увеличивается Электроотрицательность уменьшаются
- 6. Строение электронных оболочек Электроны внешнего слоя движутся попарно (спаренные электроны), или отдельно (свободные, неспаренные электроны). Количество
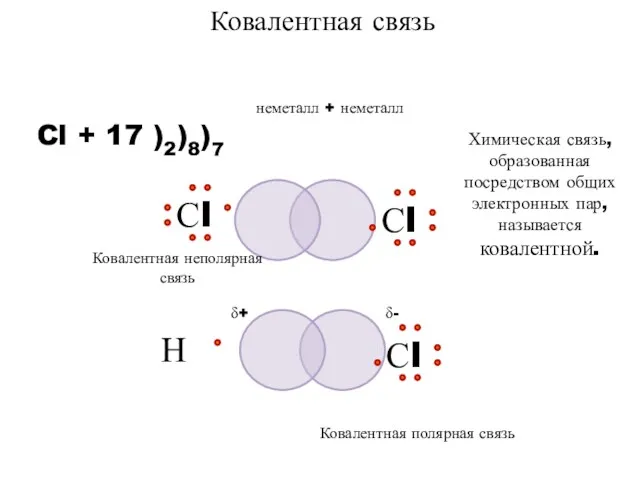
- 7. неметалл + неметалл Cl + 17 )2)8)7 Ковалентная связь Химическая связь, образованная посредством общих электронных пар,
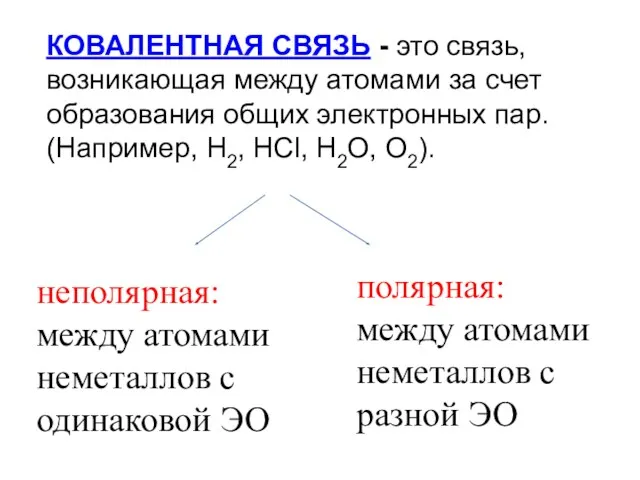
- 8. КОВАЛЕНТНАЯ СВЯЗЬ - это связь, возникающая между атомами за счет образования общих электронных пар. (Например, H2,
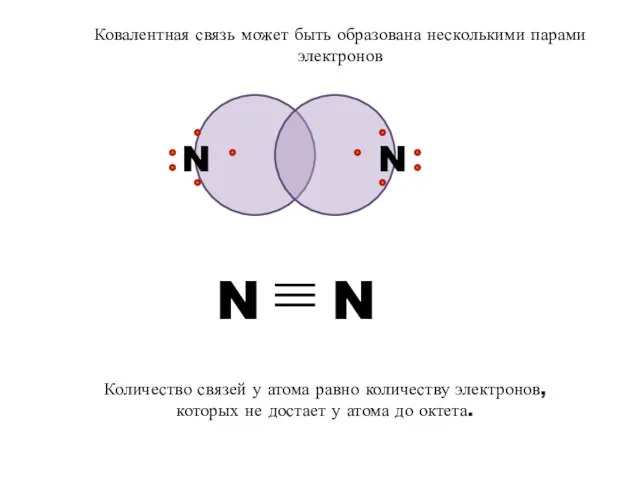
- 9. N N Ковалентная связь может быть образована несколькими парами электронов Количество связей у атома равно количеству
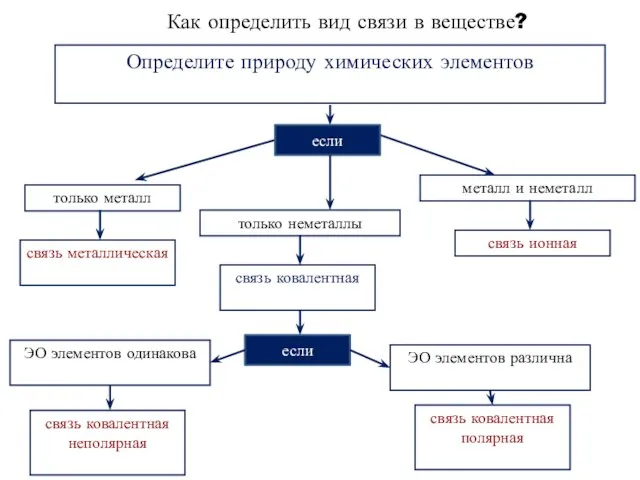
- 10. Как определить вид связи в веществе? Определите природу химических элементов если только металл только неметаллы металл
- 12. Скачать презентацию


 Металдарға жалпы сипаттама
Металдарға жалпы сипаттама Металлы в природе. Способы получения металлов
Металлы в природе. Способы получения металлов Сущность процесса электролиза
Сущность процесса электролиза Кислородсодержащие органические соединения. Спирты
Кислородсодержащие органические соединения. Спирты Химия биогенных элементов p -блока
Химия биогенных элементов p -блока Общие методические приемы в оценке качества лекарственных форм
Общие методические приемы в оценке качества лекарственных форм Кислород. Электронное строение и свойства
Кислород. Электронное строение и свойства Щелочные металлы. (9 класс)
Щелочные металлы. (9 класс) Зерттеу әдістері
Зерттеу әдістері Розв’язування задач за рівняннями реакцій з використанням розчинів із певною масовою часткою розчиненої речовини. Урок 13-14
Розв’язування задач за рівняннями реакцій з використанням розчинів із певною масовою часткою розчиненої речовини. Урок 13-14 Уравнения химических реакций
Уравнения химических реакций Периодический закон Д.И. Менделеева (лекция 3)
Периодический закон Д.И. Менделеева (лекция 3) Щавелевая кислота
Щавелевая кислота Химические свойства карбокатионов
Химические свойства карбокатионов Липиды 2. Тканевой обмен
Липиды 2. Тканевой обмен Соединения железа Fe+2 и Fe+3
Соединения железа Fe+2 и Fe+3 Металлы – простые вещества
Металлы – простые вещества Галогены VII группы. Биологическая роль и применение в медицине
Галогены VII группы. Биологическая роль и применение в медицине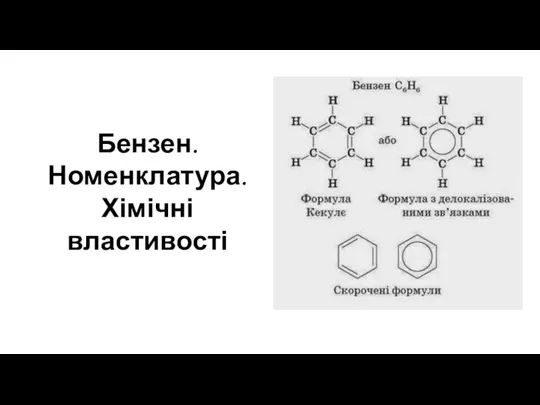 Бензен. Номенклатура. Хімічні властивості
Бензен. Номенклатура. Хімічні властивості Закон сохранения массы веществ. Химические уравнения
Закон сохранения массы веществ. Химические уравнения Олимпиадные задачи муниципального этапа по химии
Олимпиадные задачи муниципального этапа по химии Производные морфинана (фенантренизохинолина)
Производные морфинана (фенантренизохинолина) Высокомолекулярные вещества полимеры
Высокомолекулярные вещества полимеры Сорбіт C6H14O6
Сорбіт C6H14O6 Кремний и его соединения
Кремний и его соединения Все о чае
Все о чае Chemical reactions and heat. (Chapter 1)
Chemical reactions and heat. (Chapter 1) Mercury. Mercury cycle
Mercury. Mercury cycle