Содержание
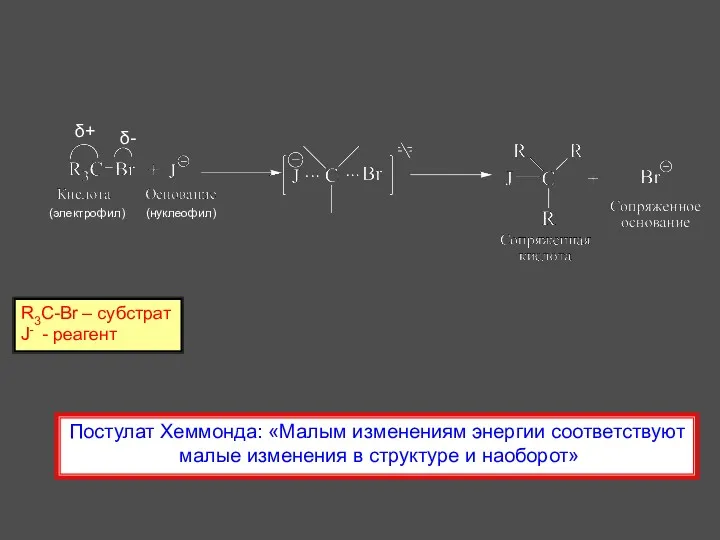
- 2. R3C-Br – субстрат J- - реагент (электрофил) (нуклеофил) Постулат Хеммонда: «Малым изменениям энергии соответствуют малые изменения
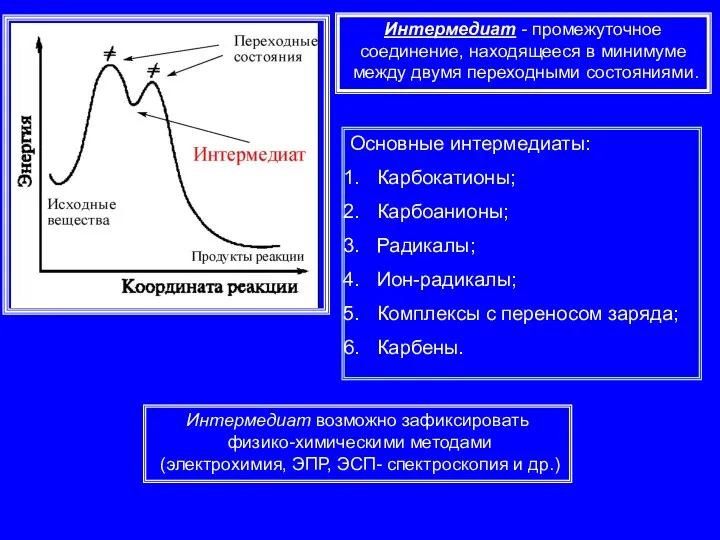
- 3. Основные интермедиаты: Карбокатионы; Карбоанионы; Радикалы; Ион-радикалы; Комплексы с переносом заряда; Карбены. Интермедиат - промежуточное соединение, находящееся
- 4. Электронные эффекты J – индуктивный эффект (эффект поля) – смещение электронного облака вдоль σ – связи
- 5. Мезомерный эффект (эффект сопряжения) Мезомерным эффектом (μ) называется эффект перераспределения электронной плотности в молекуле, происходящий с
- 6. Индуктивный и мезомерный эффекты действуют только в статичной (НЕреагирующей) молекуле В динамике имеют место ± J
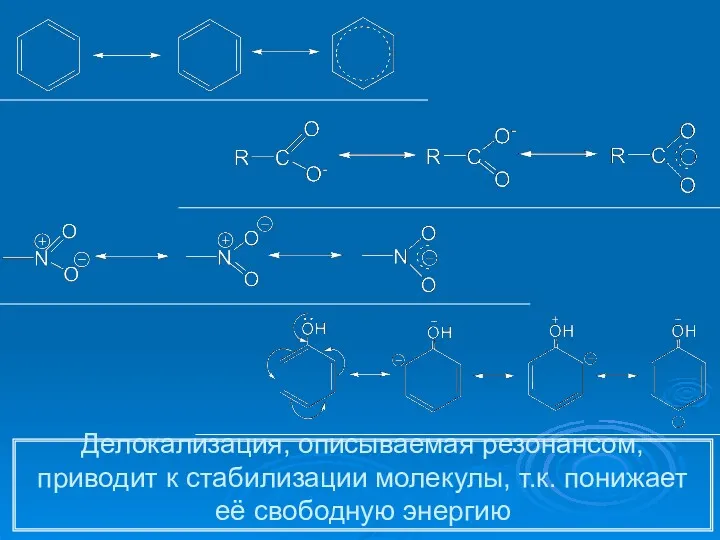
- 7. Резонанс Резонанс- способ описания реально существующей делокализации электронов. Реальная молекула при чередовании простых и двойных связей
- 8. Делокализация, описываемая резонансом, приводит к стабилизации молекулы, т.к. понижает её свободную энергию
- 9. Карбокатионы Карбкатион – частица, в которой на атоме углерода сосредоточен положительный заряд (атом углерода имеет вакантную
- 10. Методы генерирования карбокатионов Действие электрофильного реагента на кратную связь: Протонирование гетероатома с последующим отщеплением «малых молекул»:
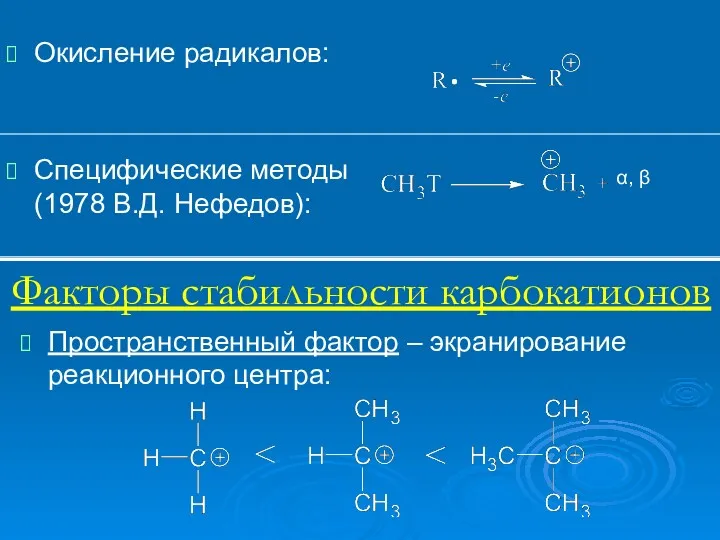
- 11. Окисление радикалов: Специфические методы (1978 В.Д. Нефедов): α, β Факторы стабильности карбокатионов Пространственный фактор – экранирование
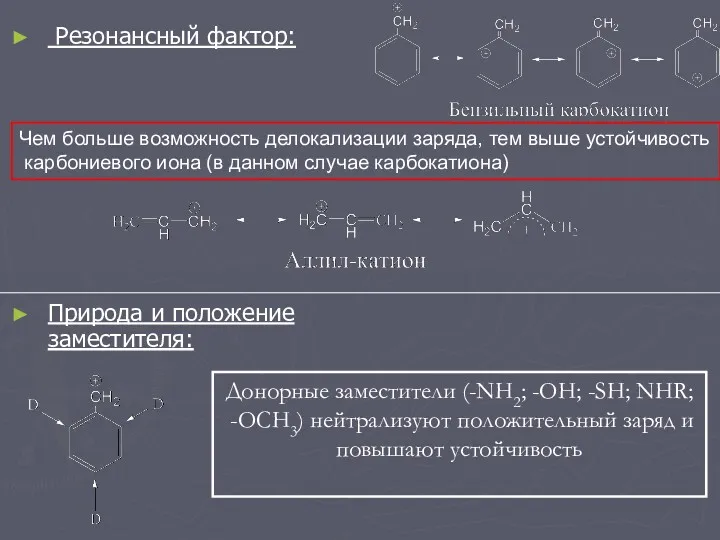
- 12. Резонансный фактор: Природа и положение заместителя: Чем больше возможность делокализации заряда, тем выше устойчивость карбониевого иона
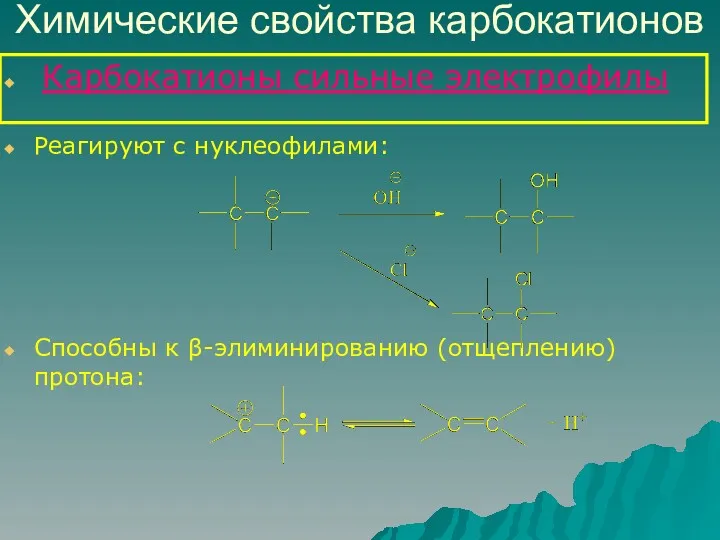
- 13. Химические свойства карбокатионов Карбокатионы сильные электрофилы Реагируют с нуклеофилами: Способны к β-элиминированию (отщеплению) протона:
- 15. Скачать презентацию






 Аммиак
Аммиак Подготовка к ГИА. В1. Периодический закон Д.И. Менделеева
Подготовка к ГИА. В1. Периодический закон Д.И. Менделеева Комплексные соединения. Определения
Комплексные соединения. Определения Коррозия металлов
Коррозия металлов Классификация органических соединений
Классификация органических соединений Производство извести
Производство извести Добування кисню
Добування кисню Водород
Водород Строение атома (лекция 3)
Строение атома (лекция 3) Окислительно-восстановительные реакции (ОВР)
Окислительно-восстановительные реакции (ОВР) Окислительно-восстановительные электроды
Окислительно-восстановительные электроды Алканы
Алканы Көмірсутектерді пиролиздеу арқылы қарапайым олефиндерді алу
Көмірсутектерді пиролиздеу арқылы қарапайым олефиндерді алу Неметаллы. Общая характеристика неметаллов
Неметаллы. Общая характеристика неметаллов Алюминий және оның қосылыстары
Алюминий және оның қосылыстары Горение топлива
Горение топлива Химические свойства кислот как электролитов
Химические свойства кислот как электролитов Свойства кислот в свете теории электролитической диссоциации
Свойства кислот в свете теории электролитической диссоциации Алкины. Ацетилены
Алкины. Ацетилены Анализ анионов. Анализ смеси солей
Анализ анионов. Анализ смеси солей Алюминий. Сплавы алюминия
Алюминий. Сплавы алюминия Защита металлоконструкций от коррозии
Защита металлоконструкций от коррозии Биофизическая химия. Предмет и задачи курса
Биофизическая химия. Предмет и задачи курса Химические реакции. Урок-обобщение
Химические реакции. Урок-обобщение Неметаллы. Общая характеристика неметаллов
Неметаллы. Общая характеристика неметаллов Исследование снежного покрова
Исследование снежного покрова Алюминий и его соединения
Алюминий и его соединения Теоретические основы получения полимеров
Теоретические основы получения полимеров