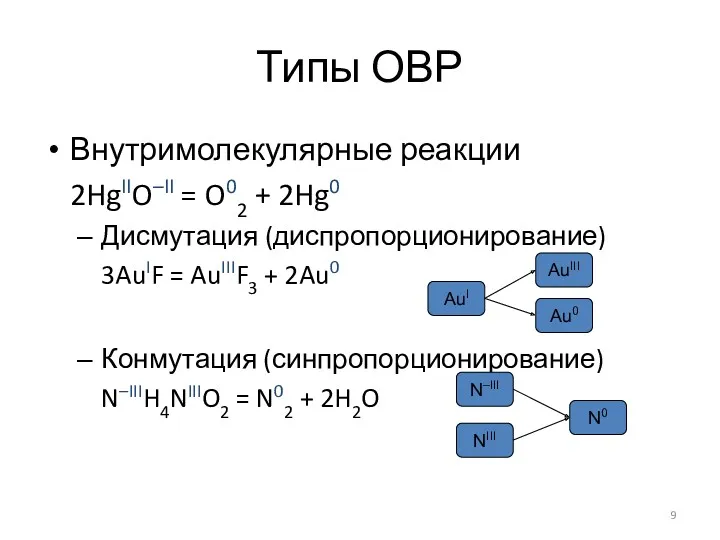
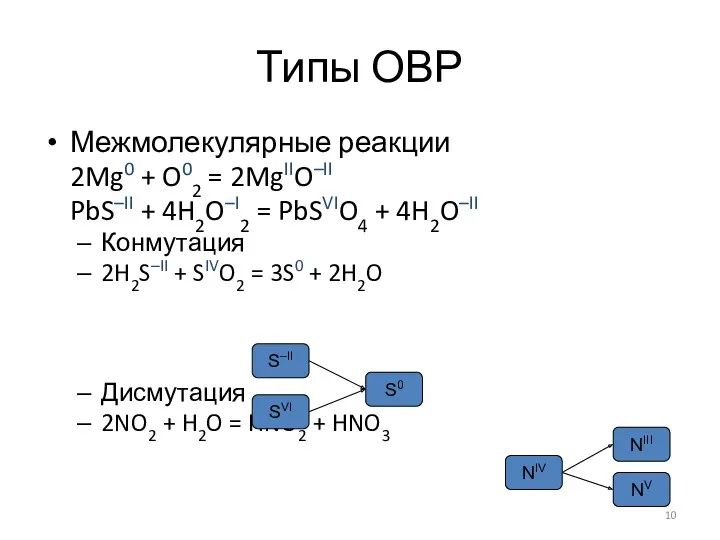
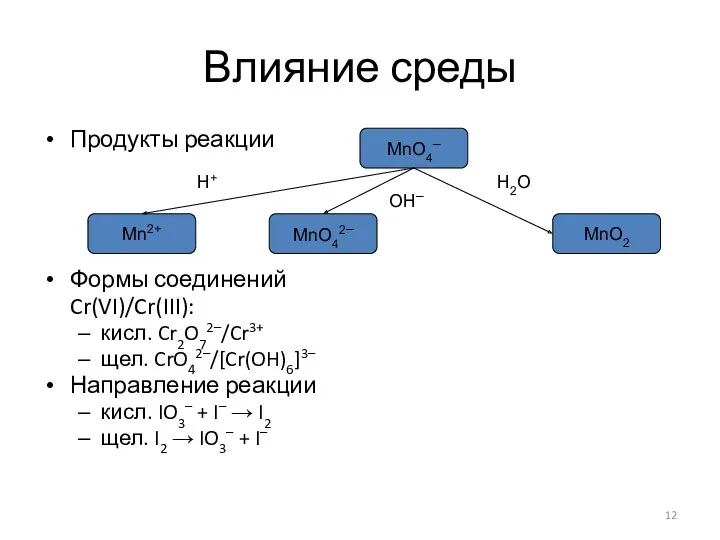
Подбор коэффициентов в уравнениях ОВР
Метод электронно-ионных полуреакций
1. Записывают формулы реагентов и
продуктов, находят окислитель, восстановитель и среду
2. Записывают формулы окислителя и восстановителя и соответствующие продукты реакции в ионном виде
3. Составляют ионные уравнения полуреакций восстановления и окисления, соблюдая для каждой из них законы сохранения числа атомов и заряда
4. Находят наименьшее общее кратное (н.о.к.) числа переданных в каждой полуреакции электронов и подбирают дополнительные множители для уравнений полуреакций так, чтобы число принятых электронов стало равным числу отданных электронов
5. Составляют ионное уравнение реакции
6. Уравнивают числа остальных атомов, участвующих в реакции, и получают уравнение реакции с подобранными коэффициентами
K2Cr2O7 + H2SO4 + H2S → S + ...
Ок Среда Вс
Cr2O72– + H+ + H2S → S + Cr3+ + H2O
Cr2O72– (Оф) → Cr3+ (Вф)
H2S (Вф) → S (Оф)
Cr2O72– + 8H+ + 6e– = 2Cr3+ + 7H2O
H2S – 2e– = S + 2H+
н.о.к. 6
Cr2O72– + 8H+ + 6e– = 2Cr3+ + 7H2O | 1
H2S – 2e– = S + 2H+ | 3
Cr2O72– + 8H+ + 3H2S = 3S + 2Cr3+ + 7H2O
K2Cr2O7 + 4H2SO4 + 3H2S = 3S + Cr2(SO4)3 + 7H2O + K2SO4






![Подбор числа атомов водорода и кислорода Кислотная среда [HI] =](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/257341/slide-7.jpg)

 Адсорбция на твердых телах
Адсорбция на твердых телах Барий. Щелочноземельные металлы
Барий. Щелочноземельные металлы Жидкие кристаллы
Жидкие кристаллы Тест: полимеры
Тест: полимеры Теория строения органического вещества. 10 класс
Теория строения органического вещества. 10 класс Экоэстафета. ученики 9 Б класса гимназии №6 г. Гродно
Экоэстафета. ученики 9 Б класса гимназии №6 г. Гродно Кислотно-основное титрование. Алкалиметрия
Кислотно-основное титрование. Алкалиметрия Экспериментальные методы физико-химических исследований. Лекция 7
Экспериментальные методы физико-химических исследований. Лекция 7 Алюминий. Строение и свойство атомов
Алюминий. Строение и свойство атомов Общая характеристика элементов VА-группы. Азот
Общая характеристика элементов VА-группы. Азот Технология монокристаллов и особо чистых веществ
Технология монокристаллов и особо чистых веществ Полимеры органические и неорганические
Полимеры органические и неорганические Спирты
Спирты Results of lab test NG RO: Bypass, UV-lamp, membrane Toray 3012 800-1000 GPD
Results of lab test NG RO: Bypass, UV-lamp, membrane Toray 3012 800-1000 GPD Методи очищення води в побуті
Методи очищення води в побуті Le trasformazioni fisiche della materia. Tema 3
Le trasformazioni fisiche della materia. Tema 3 Сложные эфиры. Жиры
Сложные эфиры. Жиры Жиры. История открытия, строение, классификация, свойства
Жиры. История открытия, строение, классификация, свойства Материаловедение как наука
Материаловедение как наука Способы получения и очистки металлов
Способы получения и очистки металлов Молекулы и атомы. Броуновское движение
Молекулы и атомы. Броуновское движение Нефть. Лекция 5
Нефть. Лекция 5 Воспользуйтесь ЛСМ Химические реакции
Воспользуйтесь ЛСМ Химические реакции Complex compounds
Complex compounds Окислительно-восстановительные реакции (ОВР). Лекция 6
Окислительно-восстановительные реакции (ОВР). Лекция 6 Понятие о СМС и моющем процессе
Понятие о СМС и моющем процессе Кислородсодержащие органические соединения
Кислородсодержащие органические соединения Карбоновые кислоты, их нахождение в природе и применение
Карбоновые кислоты, их нахождение в природе и применение