Слайд 2

Строение и свойство атомов
09.11.2016
Алюминий - элемент III группы, главной «А» подгруппы,
3 периода периодической системы, порядковый номер №13, относительная атомная масса Ar(Al) = 27. Его соседом слева в таблице является магний – типичный металл, а справа – кремний – уже неметалл. Следовательно, алюминий должен проявлять свойства некоторого промежуточного характера и его соединения являются амфотерными.
В возбужденном состоянии на внешнем уровне алюминия находится три неспаренных электрона. Поэтому в соединениях с ковалентной связью алюминий проявляет валентность III. Во всех соединениях алюминий проявляет постоянную степень
Слайд 3

Алюминий – простое вещество
09.11.2016
лёгкий парамагнитный металл серебристо-белого цвета, легко поддающийся формовке, литью, механической обработке.
Плавится при температуре 660° С. Алюминий обладает высокой тепло и электропроводностью, стойкостью к коррозии за счёт быстрого образования прочных оксидных плёнок, защищающих поверхность от дальнейшего взаимодействия.
Слайд 4

Если порошок алюминия сильно нагреть, то они воспламеняются и сгорают ослепительным
Слайд 5

Алюминий как и все металлы легко реагирует с неметаллами
09.11.2016
Слайд 6

Алюминий хорошо растворяется в разбавленных серной и соляных кислотах
09.11.2016
Слайд 7

09.11.2016
Концентрированные серная и азотная кислоты пассивируют алюминий, образуя на поверхности металла
плотную, прочную оксидную пленку, которая препятствует, которая препятствует дальнейшему протеканию реакции.
Слайд 8

Алюминий растворяется в водных растворах щелочей, образуя соли – алюминиты, которые
называются комплексными
09.11.2016
Слайд 9

Алюминий реагирует со сложными веществами:
09.11.2016
Алюминий при высокой температуре реагирует с
оксидами менее активных металлов (Алюминотермия – получение металлов: Fe, Cr, Mn, Ti, W и других, путем их восстановления алюминием)
8Al + 3Fe3O4 = 4Al2O3 + 9Fe
Слайд 10

09.11.2016
Так как алюминий – амфотерный металл, он реагирует с растворами щелочей.
При этом образуется тетрагидроксоалюминат натрия и выделяется водород:
2Al + 2NaOH + 6H2O = 2Na[Al(OH)4] + 3H2
Слайд 11

09.11.2016
При удалении оксидной пленки с поверхности алюминия, он реагирует с водой
с образованием гидроксида алюминия и водорода:
2Al + 6H2O = 2Al(OH)3 +3H2
Слайд 12

Получение алюминия
09.11.2016
Алюминий получают электролизом раствора глинозема в расплавленном криолите (Na3AIF6) и
электролизом расплава AlCl3
Слайд 13

Соединения алюминия
09.11.2016
В природе алюминий встречается только в виде соединений и
по распространенности в земной коре занимает первое место среди металлов и третье – среди всех элементов (после кислорода и кремния). Общее содержание алюминия в земной коре составляет 8,8 % по массе.
Слайд 14

Оксид алюминия Al2О3:
09.11.2016
Очень твердый (корунд, рубин)в кристаллическом состоянии, порошок белого цвета,
тугоплавкий - 20500С.
Не растворяется в воде.
Амфотерный оксид, взаимодействует:
а) с кислотами Al2O3 + 6H+ = 2Al3+ + 3H2O
б) со щелочами Al2O3 + 2OH- = 2AlO-2 + H2O
Образуется:
а) при окислении или горении алюминия на воздухе
4Al + 3O2 = 2Al2O3
б) в реакции алюминотермии
2Al + Fe2O3 = Al2O3 + 2Fe
в) при термическом разложении гидроксида алюминия 2Al (OH)3 = Al2O3 + 3H2O













 Растворы. Приготовление растворов
Растворы. Приготовление растворов Чистые вещества и смеси
Чистые вещества и смеси Органическая химия – химия соединений углерода
Органическая химия – химия соединений углерода Химия элементов VA группы (пниктогены или пникти́ды)
Химия элементов VA группы (пниктогены или пникти́ды) Кислоты НСL, H2 O, H2 CO3
Кислоты НСL, H2 O, H2 CO3 Физические явления – основа разделения смесей в химии (урок химии в 8 классе)
Физические явления – основа разделения смесей в химии (урок химии в 8 классе) Жиры. Сложные эфиры глицерина и высших карбоновых кислот
Жиры. Сложные эфиры глицерина и высших карбоновых кислот Запись атомов и молекул с помощью химических символов
Запись атомов и молекул с помощью химических символов Оксиды. Физические и химические свойства
Оксиды. Физические и химические свойства Природные источники углеводородов
Природные источники углеводородов Этапы гравиметрического анализа. (Лекция 3)
Этапы гравиметрического анализа. (Лекция 3) Механохимиялық активтеу әдісі. Реакция түрлері
Механохимиялық активтеу әдісі. Реакция түрлері Полимеры. Степень полимеризации
Полимеры. Степень полимеризации Основные физико-химические свойства нефти и нефтепродуктов
Основные физико-химические свойства нефти и нефтепродуктов Круговорот воды в природе
Круговорот воды в природе Химия в повседневной жизни человека
Химия в повседневной жизни человека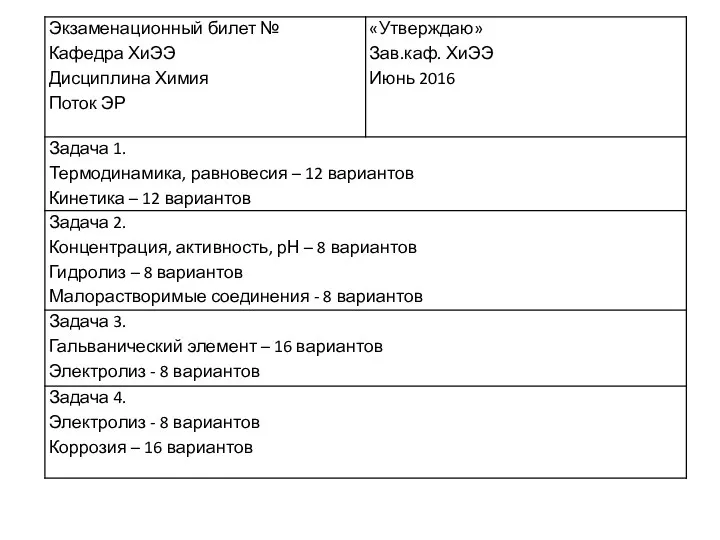 Химическая термодинамика. Задачи
Химическая термодинамика. Задачи Технологическое проектирование процессов переработки пэн
Технологическое проектирование процессов переработки пэн Тепловой эффект химической реакции, термохимические уравнения, экзо- и эндотермические реакции
Тепловой эффект химической реакции, термохимические уравнения, экзо- и эндотермические реакции Щавелевая кислота
Щавелевая кислота Высокомолекулярные соединения и супрамолекулярные структуры. Синтез полимеров (Лекция 1)
Высокомолекулярные соединения и супрамолекулярные структуры. Синтез полимеров (Лекция 1) Химические реакции. Классификация
Химические реакции. Классификация Общая характеристика элементов VА-группы. Азот
Общая характеристика элементов VА-группы. Азот Альдегіди. Будова молекул
Альдегіди. Будова молекул Рассмотрение продуктов цинкового производства при помощи аналитических методов анализа
Рассмотрение продуктов цинкового производства при помощи аналитических методов анализа Роль жиров в организме человека
Роль жиров в организме человека Изомерия органических соединений
Изомерия органических соединений Классификация органических соединений, углеводородов
Классификация органических соединений, углеводородов