Содержание
- 2. В методе осаждения анализируемый компонент: переводится в малорастворимый осадок; фильтруется; отмывается от примесей; переводится с помощью
- 3. В методе отгонки анализируемый компонент превращается в летучее соединение; улавливается; взвешивается (прямая отгонка). Углекислый газ поглощается
- 4. А- определяемый компонент m(A)=mграв.ф. обычно m(A)≠mграв.ф. где F – гравиметрический фактор, который рассчитывается как а и
- 5. определение ионов бария в виде BaSO4 Физический смысл F: как относятся молярные массы определяемого компонента и
- 6. - Требуется отделение мешающих компонентов. - В растворе необходимо создать условия, обеспечивающие малую растворимость осадка и
- 7. - растворимость осадка была как можно ниже, - осадок по возможности должен быть кристаллическим (удобным для
- 8. . 1. Осадитель должен быть специфическим или хотя бы селективным. например, диметилглиоксим является специфическим для ионов
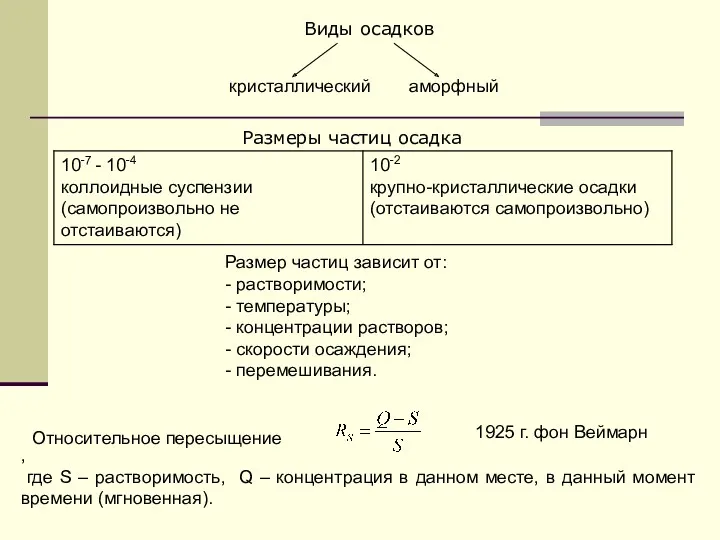
- 9. кристаллический аморфный Виды осадков Размеры частиц осадка Размер частиц зависит от: - растворимости; - температуры; -
- 10. Увеличение Т приводит к росту растворимости осадка; RS уменьшается. Это приводит к увеличению размера частиц. 2
- 11. кривая 1 (экспоненциальная кривая) соответствует скорости образования центров кристаллизации. кривая 2 (линейная кривая) характеризует скорость роста
- 12. Механизм образования осадков идет 2-мя путями: - зародышеобразование (образование центров кристаллизации); - рост уже образовавшихся кристаллов.
- 13. AgCl Ag+| NO3- AgNO3+NaCl Ионы серебра находятся в первом слое, а второй слой составляют нитрат ионы
- 14. Соосаждение - осаждение растворимых компонентов вместе с осадком. является причиной загрязнения осадка Возможны 4 типа соосаждения:
- 15. 2.В первую очередь адсорбируется тот ион, концентрация которого больше, то есть до осаждения - осаждаемый ион,
- 16. Адсорбция – поглощение вещества поверхностью твердого или жидкого адсорбента. При Т=const адсорбция увеличивается с ростом C
- 17. Окклюзия – вид соосаждения, при котором происходит захват примесей из растворителя внутрь кристалла. одной из причин
- 18. Гомогенное осаждение или метод возникающих реагентов В этом методе осадитель генерируется в растворе осаждаемого компонента. Q
- 20. Скачать презентацию
















 Химические свойства металлов
Химические свойства металлов Золото. Что о нём мы можем рассказать?
Золото. Что о нём мы можем рассказать? d-элементы
d-элементы Подготовка к ВПР по химии. 11 класс
Подготовка к ВПР по химии. 11 класс Метаболизм кетоновых тел. Метаболизм холестерина
Метаболизм кетоновых тел. Метаболизм холестерина Химический потенциал. Фазовые равновесия
Химический потенциал. Фазовые равновесия Кислотные дожди
Кислотные дожди The Molecules of Life
The Molecules of Life Цинк и его соединения
Цинк и его соединения Фосфор и его соединения
Фосфор и его соединения Химия воды
Химия воды Закономірності протікання хімічних реакцій
Закономірності протікання хімічних реакцій Классификация химических элементов
Классификация химических элементов Способы выражения состава раствора. Задача 7
Способы выражения состава раствора. Задача 7 НЮ 2.1.1. Металлы - общая характеристика
НЮ 2.1.1. Металлы - общая характеристика Гониометрическое исследование кристаллов
Гониометрическое исследование кристаллов Сплавы железа с углеродом: стали и чугуны
Сплавы железа с углеродом: стали и чугуны Багатоатомні насичені спирти. Фізичні та хімічні властивості. Добування і застосування
Багатоатомні насичені спирти. Фізичні та хімічні властивості. Добування і застосування Мінерали та гірські породи
Мінерали та гірські породи Серная кислота
Серная кислота Electrolysis
Electrolysis Вещества
Вещества Карбон қышқылдары, жіктелуі, сипаттамалары, таралуы
Карбон қышқылдары, жіктелуі, сипаттамалары, таралуы Аминокислоты 2
Аминокислоты 2 Метаболизм углеводов
Метаболизм углеводов Спектральные методы: атомная спектроскопия
Спектральные методы: атомная спектроскопия Валентность и степень окисления. Химическая связь
Валентность и степень окисления. Химическая связь Альдегіди. Карбонові кислоти. Одержання. Фізичні та хімічні властивості
Альдегіди. Карбонові кислоти. Одержання. Фізичні та хімічні властивості