Содержание
- 2. План Енергетика хімічних реакцій. Загальні поняття І- закон термодинаміки. Ентальпія. Закон Гесса і наслідки з закону.
- 3. Тепловий ефект хімічної реакції – Q – це кількість теплоти , що виділяється або поглинається під
- 4. Види систем Відкриті Закриті Ізольовані Гомогенні Гетерогенні Ізобарні Ізохорні Ізотермічні Система – це будь-яка обмежена яким-небудь
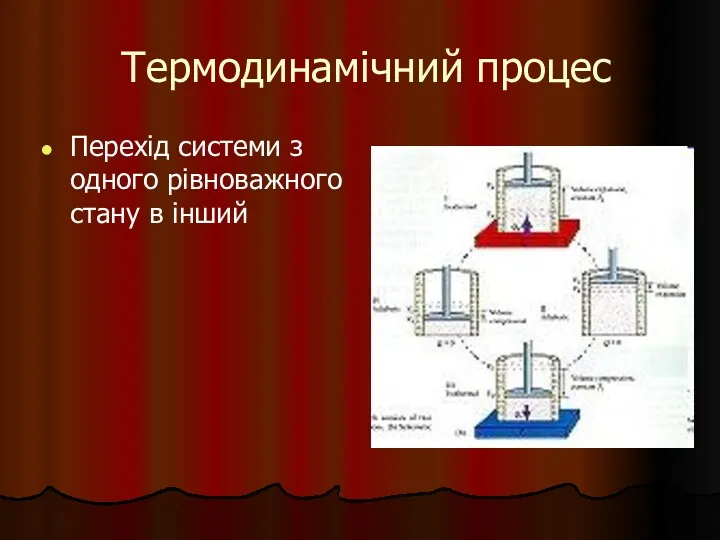
- 5. Термодинамічний процес Перехід системи з одного рівноважного стану в інший
- 6. Параметри систем Параметри – це показники, що характеризують стан системи: температура, тиск, об'єм, густина та ін.
- 7. Функції стану системи Внутрішня енергія системи (U)– це загальний запас енергії системи, що складається з енергії
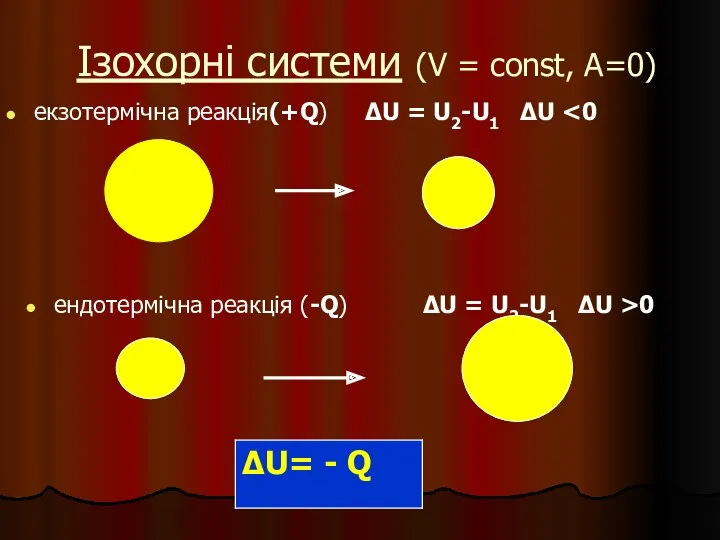
- 8. Ізохорні системи (V = const, A=0) екзотермічна реакція(+Q) ∆U = U2-U1 ∆U ендотермічна реакція (-Q) ∆U
- 9. ЕНТАЛЬПІЯ U + P∙ V = H – ентальпія – тепловмість системи Q = - ΔH
- 10. Ізобарні системи (Р = const, A≠0) Перший закон термодинаміки (1847 Г.Гельмгольц) Теплота, яку отримує система витрачається
- 11. Закони термохімії Закон Лавуазьє-Лапласа: Ентальпія утворення даної сполуки чисельно дорівнює ентальпії її розкладання з протилежним знаком.
- 12. Закон Гесса Тепловий ефект залежить тільки від стану вихідних і кінцевих продуктів, і не залежить від
- 13. Наслідки з закону Гесса ΔHх.р. = ∑ nΔHутв. продуктів - ∑nΔHутв. поч. речовин 2 H2S +
- 14. Залежність теплового ефекту від температури Теплоємність (середня) системи дорівнює кількості теплоти, яку необхідно підвести або відвести
- 15. Залежність теплоємності від температури При сталому тиску теплота отримана системою йде на зміну ентальпії CP=ΔH/ΔT СP=
- 16. Залежність Кірхгофа інтегрування рівняння теплоємності від Т1 до Т2 отримаємо залежність ентальпії від температури (Залежність Кірхгофа)
- 17. Принцип Бертло (1867р.): принцип самочинного перебігу хімічних реакцій: Самочинно протікають лише ті процеси, що супроводжуються виділенням
- 18. Термодинамічна імовірність W Кількість мікростанів, з яких складається макроскопічний стан системи, називається термодинамічною імовірністю W. Термодинамічна
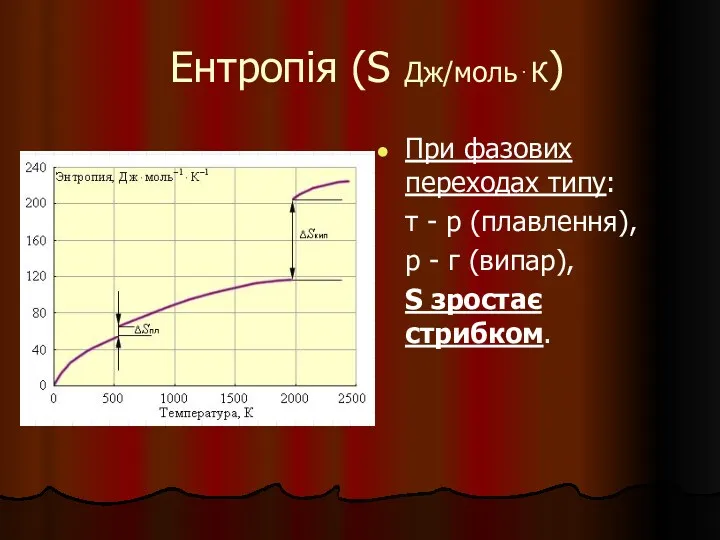
- 19. Ентропія (S Дж/моль⋅К) При фазових переходах типу: т - р (плавлення), р - г (випар), S
- 20. Ентропія (S Дж/моль⋅К) Кількісною мірою ймовірності стану, невпорядкованості, безладдя – є ентропія S. S = klnW,
- 21. ІІ – закон термодинаміки (1850 Р.Клаузиус ) Будь-яка ізольована система представлена сама собі змінюється в напрямку
- 22. Енергія Гіббса
- 23. Енергія Гіббса а) – оборотний процес; б) необоротний процес
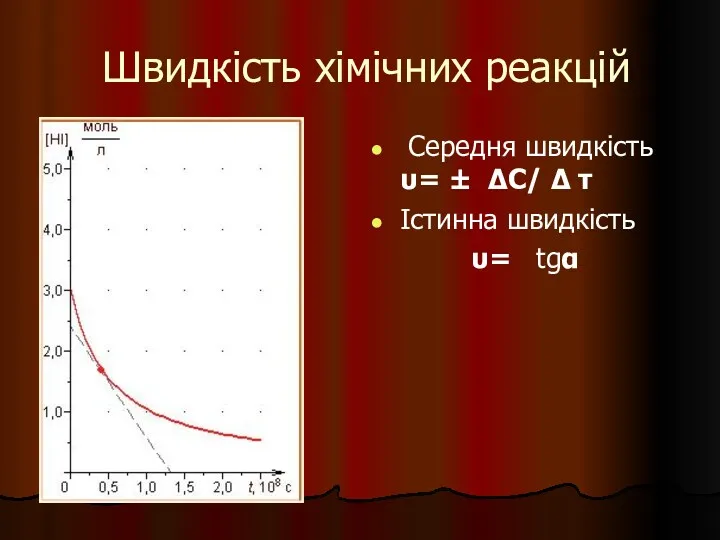
- 24. Швидкість хімічних реакцій Середня швидкість υ= ± ΔC/ Δ τ Істинна швидкість υ= tgα
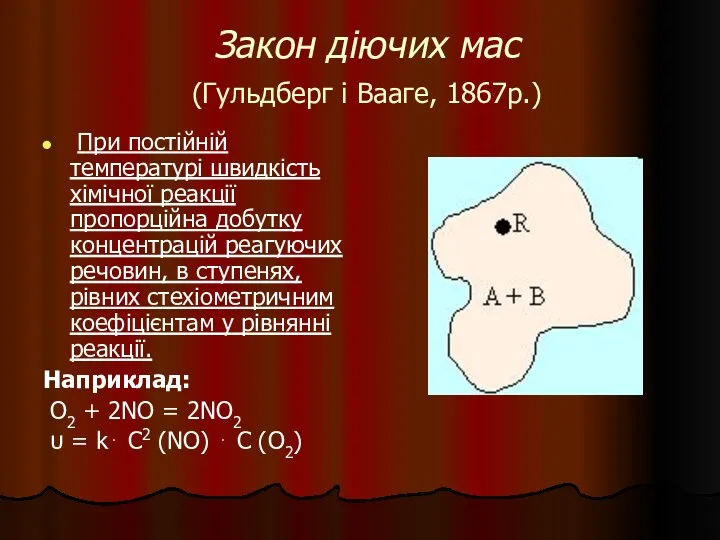
- 25. Закон діючих мас (Гульдберг і Вааге, 1867р.) При постійній температурі швидкість хімічної реакції пропорційна добутку концентрацій
- 26. Залежність швидкості реакції від температури правило Вант-Гоффа швидкість збільшується приблизно в 2÷4 рази при підвищенні температури
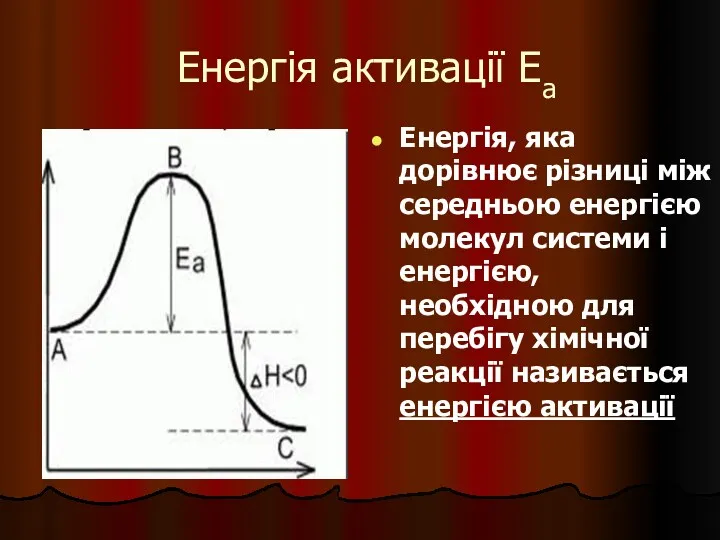
- 27. Енергія активації Еа Енергія, яка дорівнює різниці між середньою енергією молекул системи і енергією, необхідною для
- 28. Рівняння Арреніуса Залежність швидкості реакції від температури й енергії активації визначається рівнянням Арреніуса: де, А –
- 29. Каталіз Каталіз – це прискорення хімічної реакції речовиною каталізатором. Каталізатор – речовина, що прискорює хімічні реакції,
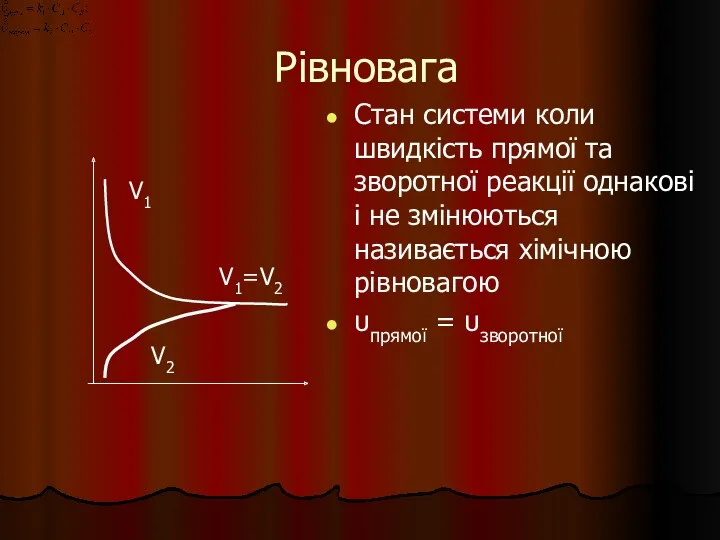
- 30. Рівновага Стан системи коли швидкість прямої та зворотної реакції однакові і не змінюються називається хімічною рівновагою
- 31. Константа хімічної рівноваги Реакція відбувається за рівнянням: А + В ⇔ D + E υпрям =
- 32. Зміщення рівноваги Принцип Ле-Шательє: Якщо на систему, що знаходиться в стані рівноваги подіяти зовнішнім фактором, то
- 33. Каталізатор Каталізатор – речовина, що прискорює хімічні реакції, але сам якісно і кількісно не змінюється Механізм
- 34. Ферменти (ензими) В 1902 р. в лабораторії І. П. Павлова були одержані докази білкової природи ферменту
- 35. Склад ферментів Білкова частина – апофермент; Небілкова частина – кофактор може мати неорганічну природу, наприклад Fe2+,
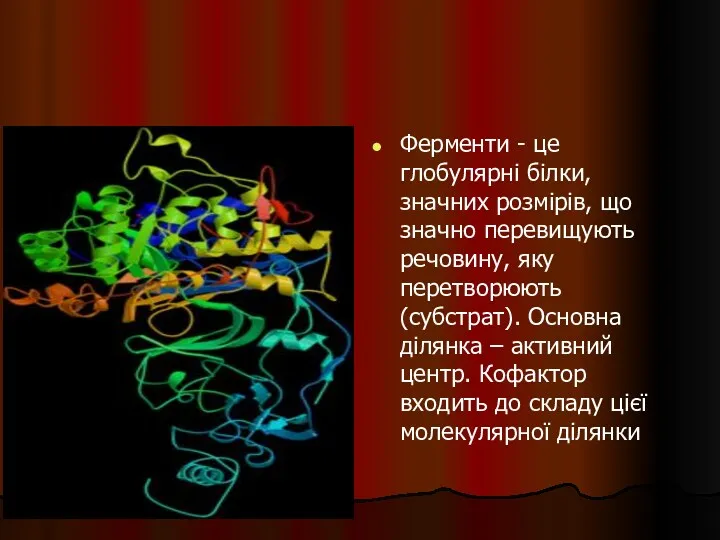
- 36. Ферменти - це глобулярні білки, значних розмірів, що значно перевищують речовину, яку перетворюють (субстрат). Основна ділянка
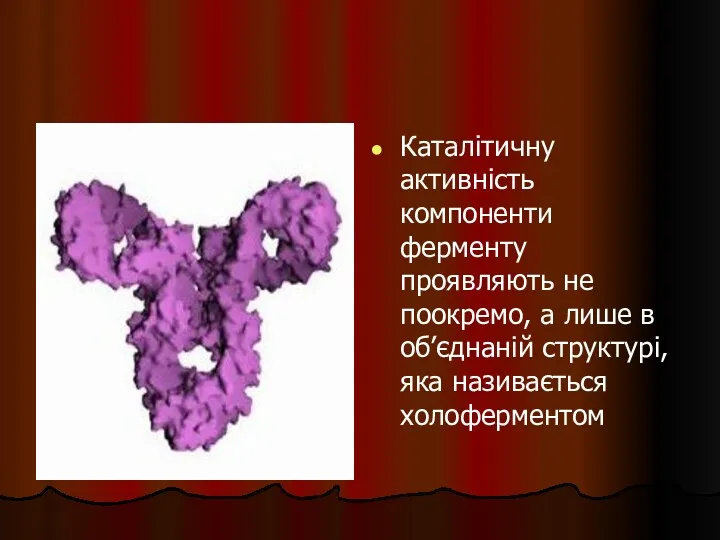
- 37. Каталітичну активність компоненти ферменту проявляють не поокремо, а лише в об’єднаній структурі, яка називається холоферментом
- 39. Скачать презентацию



























 Ртуть и цинк
Ртуть и цинк Драгоценные камни
Драгоценные камни Соли, их классификация и свойства
Соли, их классификация и свойства Степень окисления. Определение степени окисления в соединениях
Степень окисления. Определение степени окисления в соединениях Теория электролитической диссоциации
Теория электролитической диссоциации Химия и биологическая роль элементов VIIА-группы
Химия и биологическая роль элементов VIIА-группы Студенттің өзіндік жұмысы
Студенттің өзіндік жұмысы Составление уравнений химических реакций. Закон сохранения массы веществ
Составление уравнений химических реакций. Закон сохранения массы веществ Водород
Водород Соединения кальция. Жесткость воды и способы её устранения
Соединения кальция. Жесткость воды и способы её устранения Алкени (етиленові вуглеводні, олефіни)
Алкени (етиленові вуглеводні, олефіни) Коррозия металлов
Коррозия металлов Строение, свойства и применение алкенов
Строение, свойства и применение алкенов Дистилляция в химической промышленности
Дистилляция в химической промышленности Хлорид натрия (NaCI)
Хлорид натрия (NaCI) Кислород. Озон. Получение кислорода
Кислород. Озон. Получение кислорода Өндірілетін және тиелетін өнімнің сапасын бақылау, оларға қойылатын талаптар
Өндірілетін және тиелетін өнімнің сапасын бақылау, оларға қойылатын талаптар 20230802_stroenie_atoma_avtosohranennyy_2
20230802_stroenie_atoma_avtosohranennyy_2 Хімічні властивості алкенів
Хімічні властивості алкенів Биоразлагаемые ПАВ. Лекция 2
Биоразлагаемые ПАВ. Лекция 2 Принципы наноармирования волокнистых композитов
Принципы наноармирования волокнистых композитов Химическая посуда и лабораторное оборудование
Химическая посуда и лабораторное оборудование Альдегиды и кетоны
Альдегиды и кетоны Искусственная и синтетическая резина
Искусственная и синтетическая резина Мұнай құрамындағы тұздың мөлшерін анықтау
Мұнай құрамындағы тұздың мөлшерін анықтау Неомыляемые липиды. Изопреноиды
Неомыляемые липиды. Изопреноиды Задачи на избыток-недостаток
Задачи на избыток-недостаток Синтетический каучук и его применение
Синтетический каучук и его применение