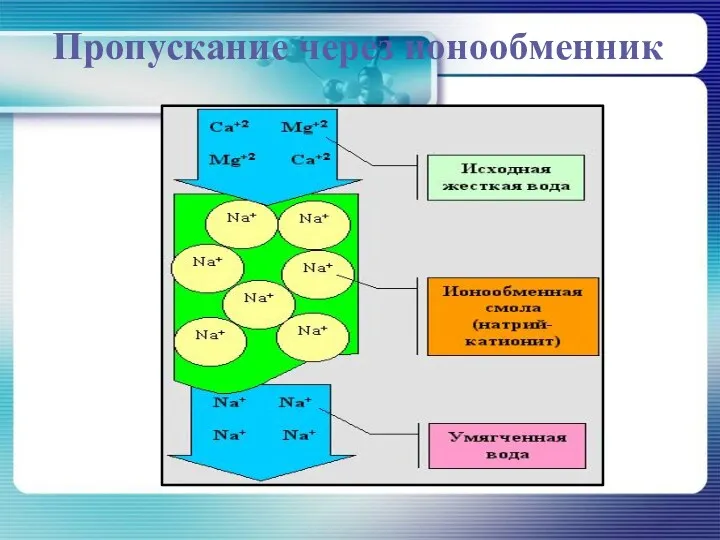
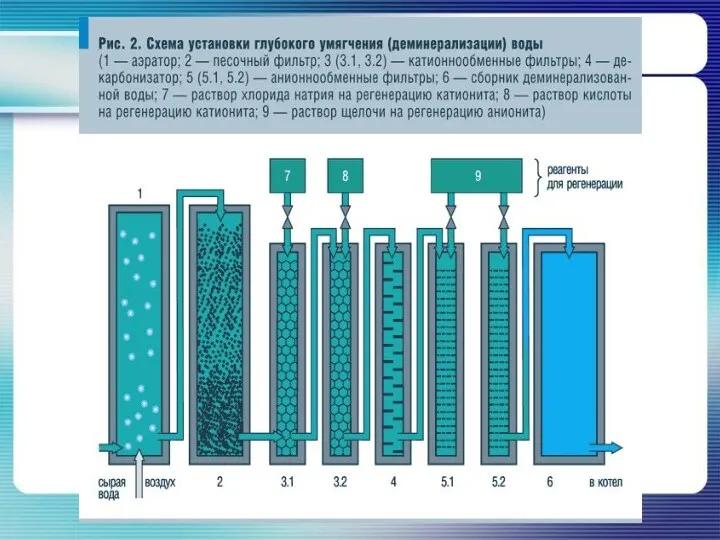
Способы устранения жесткости воды
Временная или карбонатная жёсткость
В воде присутствуют катионы
Са2+ и Мg2+, а также анионы НСО3-.
Способы устранения:
1) Кипячение
Ca(HCO3)2 t= CaCO3↓ + CO2↑+ H2O
Mg(HCO3)2 t= MgCO3↓ + CO2↑+ H2O
2) Химический способ
а) добавление известкового молока
Са(НСО3)2 + Са(ОН)2 = 2СаСO3↓ + 2Н2O
б) добавление соды
Ca(НСО3)2 + Na2CO3 =CaCO3↓ + NaНСО3
Постоянная или некарбонатная жёсткость
В воде присутствуют катионы Са2+ и Мg2+, а также анионы SO42-, Cl-.
Способы устранения:
1) добавление соды
CaSO4 + Na2CO3 = CaCO3↓ + Na2SO4
MgSO4 + Na2CO3 = MgCO3↓ +Na2SO4
Общая жёсткость
В воде присутствуют катионы Са2+ и Мg2+, а также анионы SO42-, CL-,НСО3-
Способы устранения: Добавление соды, известкового молока









 Автомобильные пластичные смазки
Автомобильные пластичные смазки Химический КВИЗ
Химический КВИЗ Физико-химия дисперсных систем. Коллоидные растворы
Физико-химия дисперсных систем. Коллоидные растворы Жиры и масла
Жиры и масла Фосфор
Фосфор Органикалық қосылыстардың
Органикалық қосылыстардың Alyuminiy_ego_soedinenia
Alyuminiy_ego_soedinenia Гигиена труда при работе с пестицидами и минеральными удобрениями
Гигиена труда при работе с пестицидами и минеральными удобрениями Кислородные соединения азота
Кислородные соединения азота Симметрия в химии
Симметрия в химии Ковалентний зв’язок. Донорно - акцепторний механізм утворення ковалентного зв'язку
Ковалентний зв’язок. Донорно - акцепторний механізм утворення ковалентного зв'язку Вода – это жизнь!
Вода – это жизнь! Показатели химической обстановки при авариях на химически опасных объектах
Показатели химической обстановки при авариях на химически опасных объектах Применение солей
Применение солей Спектральные методы: инфракрасная спектроскопия. Люминесцентный анализ
Спектральные методы: инфракрасная спектроскопия. Люминесцентный анализ Введение в кристаллографию
Введение в кристаллографию Субстраты и продукты биохимических реакций
Субстраты и продукты биохимических реакций Высшие жирные кислоты. Липиды
Высшие жирные кислоты. Липиды Электрохимические процессы. Лекция 7
Электрохимические процессы. Лекция 7 Окислительно-восстановительные реакции в аналитической химии
Окислительно-восстановительные реакции в аналитической химии Поліметилметакрилат
Поліметилметакрилат Развивающие занятия в ГПД Поделочные камни
Развивающие занятия в ГПД Поделочные камни Простые и сложные вещества
Простые и сложные вещества Проект Кабинет химии будущего
Проект Кабинет химии будущего Электролиз. Электролиз раствора и электролиз расплава электролита
Электролиз. Электролиз раствора и электролиз расплава электролита Химико-лесной комплекс
Химико-лесной комплекс Двовимірний ямр. Приклади
Двовимірний ямр. Приклади Основные сведения о строении атома
Основные сведения о строении атома