Содержание
- 2. НЕЙТРОН ЭЛЕКТРОН АТОМ ЯДРО ПРОТОН
- 3. Основные сведения о строении атома
- 4. Дж. Томсон (1904 г.) «Пудинг с изюмом» - атом состоит из положительного заряда, равномерно распространенного по
- 5. Э. Резерфорд (1911 г.) Планетарная, или ядерная, модель атома внутри атома находится положительно заряженное ядро, занимающее
- 6. Н. Бор (1913 г.) Квантовые постулаты электроны в атоме вращаются по строго определенным замкнутым орбитам, не
- 7. Современная квантовая модель строения атома Электрон имеет двойственную (корпускулярно-волновую) природу: - подобно частице, электрон имеет массу
- 8. Атом — это наименьшая частица химического элемента, сохраняющая все его химические свойства. Атом состоит из ядра,
- 9. Ядро атома Ядро состоит из нуклонов - протонов и нейтронов. Протон – р+ Количество протонов (Z)
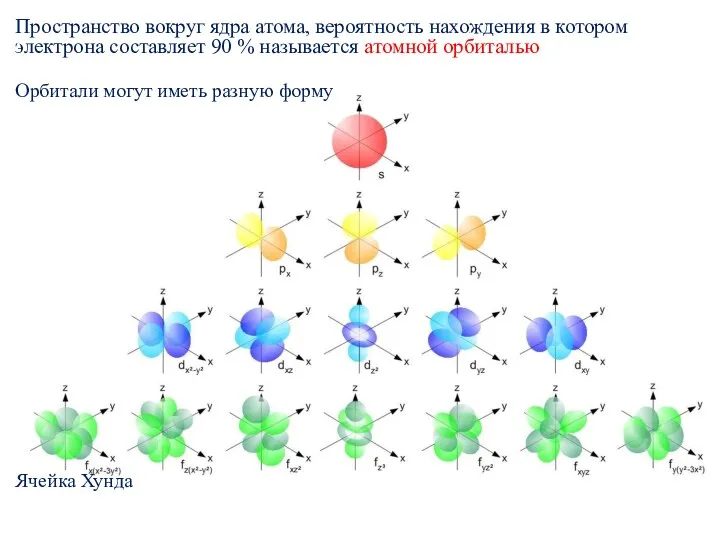
- 10. Пространство вокруг ядра атома, вероятность нахождения в котором электрона составляет 90 % называется атомной орбиталью Орбитали
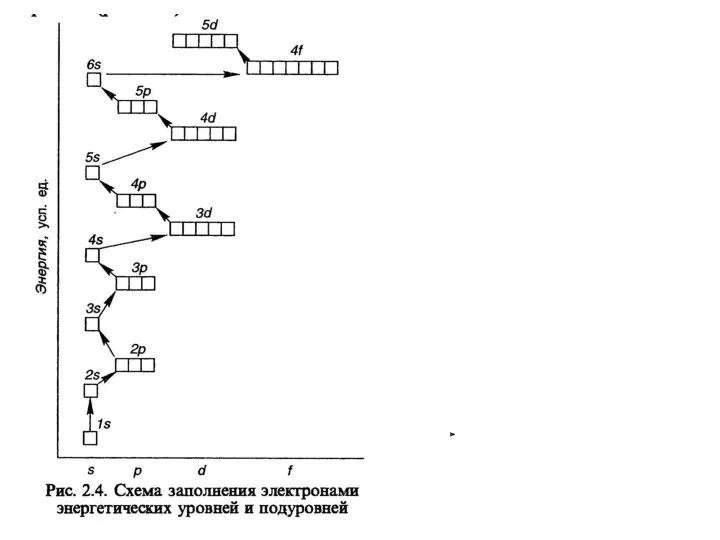
- 11. Электронная оболочка атома Под электронной оболочкой понимают совокупность всех электронов в атоме. Электроны близкие по энергии
- 13. H He Li Be Bий.
- 14. Напишите электронные и электронно – структурные конфигурации атомов следующих элементов: N Si Fe Kr Te W
- 16. Скачать презентацию










 Химия: классификация химических реакций
Химия: классификация химических реакций Азотсодержащие соединения
Азотсодержащие соединения Бытовая химия
Бытовая химия Сульфиды — природные сернистые соединения металлов и некоторых неметаллов
Сульфиды — природные сернистые соединения металлов и некоторых неметаллов Химическая организация клетки. Неорганические вещества, входящие в состав клетки
Химическая организация клетки. Неорганические вещества, входящие в состав клетки Растворение. Растворы
Растворение. Растворы Открытие Периодического закона
Открытие Периодического закона Тест по неорганической химии
Тест по неорганической химии Фотолабораторный процесс. Основные этапы фото обработки. Рентгеновского изображения
Фотолабораторный процесс. Основные этапы фото обработки. Рентгеновского изображения Кобальт. Нахождение в природе. Получение
Кобальт. Нахождение в природе. Получение Энергетикалық деңгейлер
Энергетикалық деңгейлер Растворы ВМС
Растворы ВМС Основные виды химических связей
Основные виды химических связей Оксиды. Классификация. Номенклатура. Физические свойства оксидов. Химические свойства оксидов. Получение и применение оксидов
Оксиды. Классификация. Номенклатура. Физические свойства оксидов. Химические свойства оксидов. Получение и применение оксидов Organic compounds: nomenclature
Organic compounds: nomenclature 5.Алкины
5.Алкины Углеводы. Моносахариды
Углеводы. Моносахариды Жёсткость воды и способы её устранения
Жёсткость воды и способы её устранения Соединения галогенов
Соединения галогенов Алюминий и его соединения
Алюминий и его соединения Галогены
Галогены Основы химической термодинамики
Основы химической термодинамики Химические свойства кислот
Химические свойства кислот Переработка нефти. Крекинг
Переработка нефти. Крекинг Органічні розчинники. 11 клас
Органічні розчинники. 11 клас Топлива и их свойства
Топлива и их свойства Алотропні модифікації неметалів
Алотропні модифікації неметалів Рецепты литературы в химических опытах
Рецепты литературы в химических опытах