Оксиды. Классификация. Номенклатура. Физические свойства оксидов. Химические свойства оксидов. Получение и применение оксидов презентация
Содержание
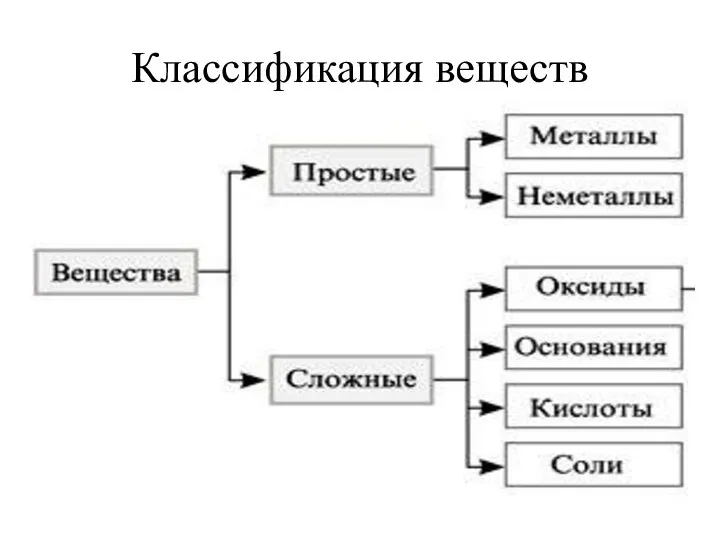
- 2. Классификация веществ
- 4. Оксиды - это сложные вещества, состоящие из двух химических элементов, один из которых кислород, с валентность
- 5. Номенклатура: «оксид» + «название элемента в Р.п.» Если валентность химического элемента переменная, то указывается римской цифрой,
- 6. Задание 1: Дайте названия оксидам: ZnO, K2O, CO, N2O, CO2, NO2, BaO, CaO, CrO, Cr2O, CrO3
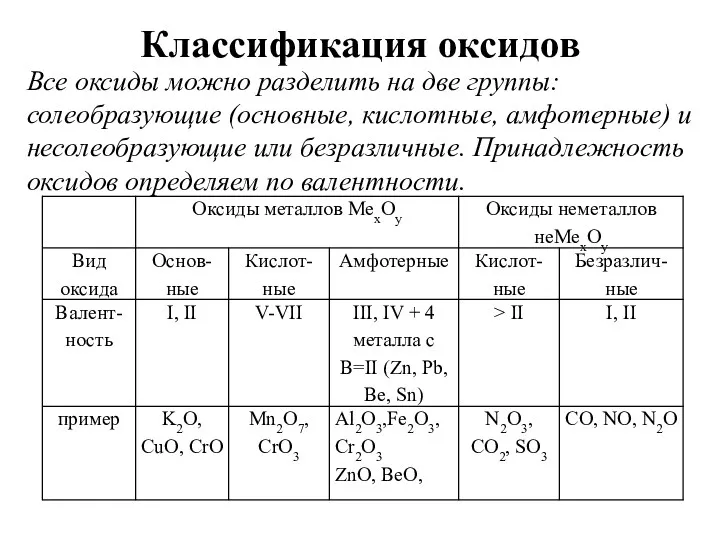
- 7. Классификация оксидов Все оксиды можно разделить на две группы: солеобразующие (основные, кислотные, амфотерные) и несолеобразующие или
- 8. 1) Основные оксиды – это оксиды, которым соответствуют основания. К основным оксидам относятся оксиды металлов 1
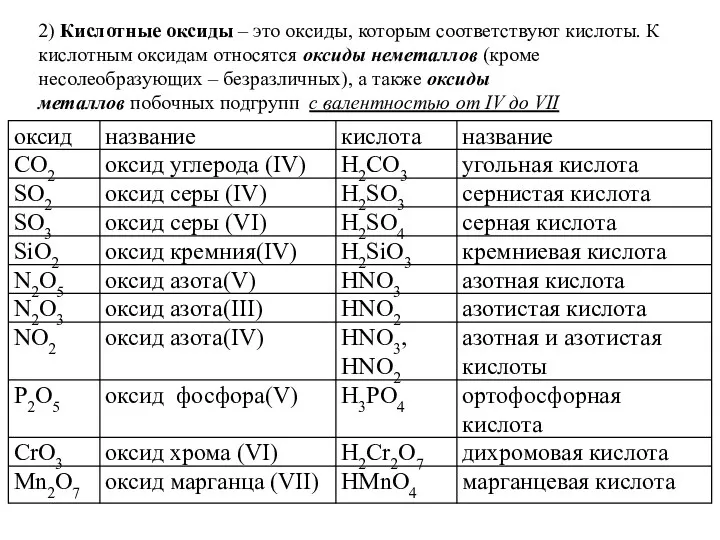
- 9. 2) Кислотные оксиды – это оксиды, которым соответствуют кислоты. К кислотным оксидам относятся оксиды неметаллов (кроме
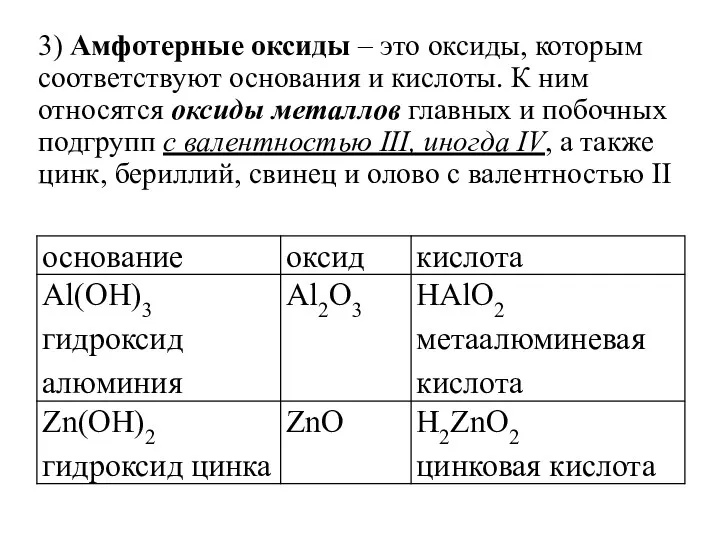
- 10. 3) Амфотерные оксиды – это оксиды, которым соответствуют основания и кислоты. К ним относятся оксиды металлов
- 11. 4) Несолеобразующие (безразличные) оксиды – это оксиды безразличные к кислотам и основаниям. К ним относятся оксиды
- 12. Классификация оксидов (по растворимости в воде)
- 13. Задание 2: 1. Выпишите отдельно химические формулы солеобразующих кислотных и основных оксидов: NaOH, AlCl3, K2O, H2SO4,
- 14. Получение оксидов
- 15. ХИМИЧЕСКИЕ СВОЙСТВА ОСНОВНЫХ ОКСИДОВ (правила знать наизусть) 1. Основной оксид + Кислотный оксид = Соль (р.
- 16. ХИМИЧЕСКИЕ СВОЙСТВА КИСЛОТНЫХ ОКСИДОВ (правила знать наизусть) 1. Кислотный оксид + вода = Кислота(р. соединения): SO2
- 17. ХИМИЧЕСКИЕ СВОЙСТВА АМФОТЕРНЫХ ОКСИДОВ (правила знать наизусть) Взаимодействуют как с кислотами, так и со щелочами. 1.
- 18. Задание3: Закончите УХР, укажите тип реакции, назовите продукты реакции а) Na2O + H2O = б) N2O5
- 20. Скачать презентацию













 Металлы и сплавы с высокой удельной прочностью
Металлы и сплавы с высокой удельной прочностью Химическая термодинамика
Химическая термодинамика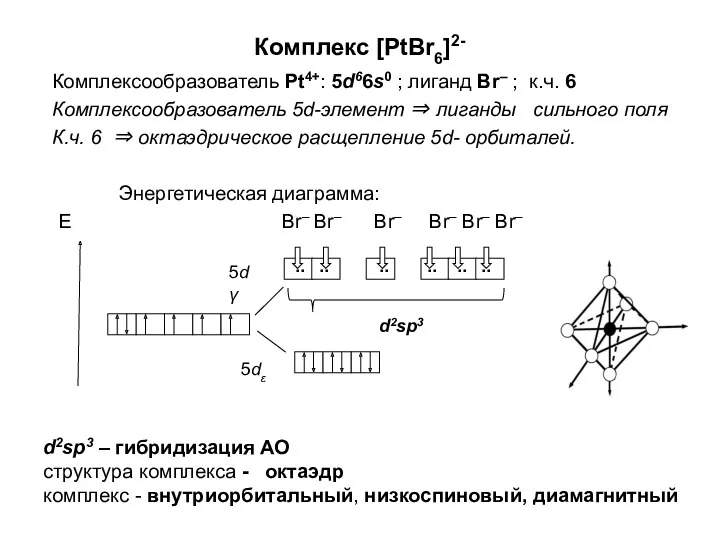 Комплексообразователь. (Лекция 5)
Комплексообразователь. (Лекция 5)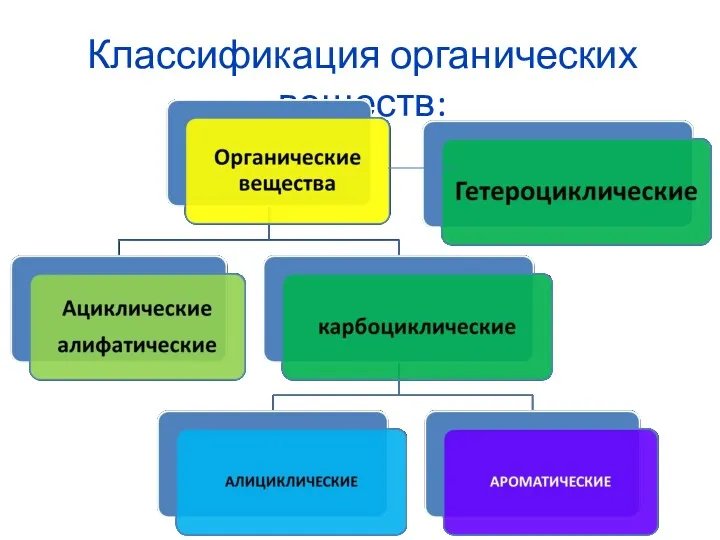 Классификация органических веществ
Классификация органических веществ Сравнительная характеристика галогенов
Сравнительная характеристика галогенов Амин қышқылдар
Амин қышқылдар Металлы и сплавы, их строение. Классификация и маркировка сталей. Влияние химических элементов на свариваемость
Металлы и сплавы, их строение. Классификация и маркировка сталей. Влияние химических элементов на свариваемость Фенол и его свойства. (10 класс)
Фенол и его свойства. (10 класс) Строение атома
Строение атома Липиды. Классификация липидов
Липиды. Классификация липидов Крахмал. Строение вещества
Крахмал. Строение вещества Значення хімії у житті людини
Значення хімії у житті людини Определение нефтепродуктов в воде с использованием Флюората-02-5М
Определение нефтепродуктов в воде с использованием Флюората-02-5М Каменный уголь
Каменный уголь Экспертные системы распознавания химических веществ
Экспертные системы распознавания химических веществ Бензо́л (C6H6, PhH)
Бензо́л (C6H6, PhH) Поняття про валентність. Ребус
Поняття про валентність. Ребус Текстовые задачи на проценты, смеси и сплавы
Текстовые задачи на проценты, смеси и сплавы Строение и свойства металлов. Физические и механические свойства металлов
Строение и свойства металлов. Физические и механические свойства металлов Игровая программа по химии Самый умный. Химические свойства оксидов, оснований, кислот и солей
Игровая программа по химии Самый умный. Химические свойства оксидов, оснований, кислот и солей Природные источники углеводородов
Природные источники углеводородов Покрытия: виды, принципы создания, свойства, применение. Получение покрытий золь-гель методом. Супергидрофобные покрытия
Покрытия: виды, принципы создания, свойства, применение. Получение покрытий золь-гель методом. Супергидрофобные покрытия Органическая химия
Органическая химия 21. Кислоты. Определение кислот
21. Кислоты. Определение кислот Бериллий, магний и щелочноземельные металлы
Бериллий, магний и щелочноземельные металлы Общая характеристика неметаллов
Общая характеристика неметаллов Сера. Аллотропия серы. Физические и химические свойства серы. Применение серы
Сера. Аллотропия серы. Физические и химические свойства серы. Применение серы Р-элементы VI A группы. Свойства их соединений
Р-элементы VI A группы. Свойства их соединений