Содержание
- 2. Координационное число 4 1. Если комплексообразователь 3d – элемент и лиганды слабого поля ⇒ тетраэдрическое расщепление.
- 3. комплекс [Au(NH3)4]3+ Комплексообразователь Au3+: 5d86s0 ; лиганд NH3 ; к.ч. 4 комплексообразователь 5d- элемент ⇒ все
- 4. комплекс [NiCl4]2- комплексообразователь Ni2+: 3d84s2 ; лиганд Cl– ; к.ч. 4 Т.к. комп-тель 3d-элемент => по
- 5. Спектр видимого излучения и дополнительные цвета
- 6. Окраска комплексных соединений При поглощении кванта света (hν) электрон переходит с подуровня d, имеющего более низкую
- 7. Гексаакватитан (III) [Ti(H2O)6]3+ Комплекс поглощает свет в желто-зеленой области спектра (20300 см-1, λ≈ 500 нм). Это
- 8. комплекс [Сu(NH3)4]2+ Комплексообразователь Сu2+: 3d94s0 ; лиганд NH3 ; к.ч. 4 комплексообразователь 3d- элемент ⇒ для
- 9. Ионная химическая связь А - nē→ Аn+ (катионы) А + nē→ Аn- (анионы) Электростатическое взаимодействие между
- 10. Вандерваальсовы силы Силы И.Ван-дер-Ваальса (Голландия, 1873г.) – силы межмолекулярного взаимодействия, проявляющиеся на расстояниях, превосходящих размеры частиц
- 11. Вклад отдельных составляющих в энергию межмолекулярного взаимодействия Е дисп. > Е ор. > Е инд. Е
- 12. ВОДОРОДНАЯ СВЯЗЬ Химическая связь, образованная положительно поляризованным водородом молекулы А-Н (или полярной группы) и электроотри- цательным
- 13. ► Е(н-связи) возрастает с ↑ ЭО и ↓ размеров атомов В -Н ... F- > -Н
- 14. Изменение Т кип. в ряду однотипных молекул Н2О, НF и NН3 - аномально высокие Ткип и
- 16. Скачать презентацию
 Романенко
Романенко Щелочные металлы
Щелочные металлы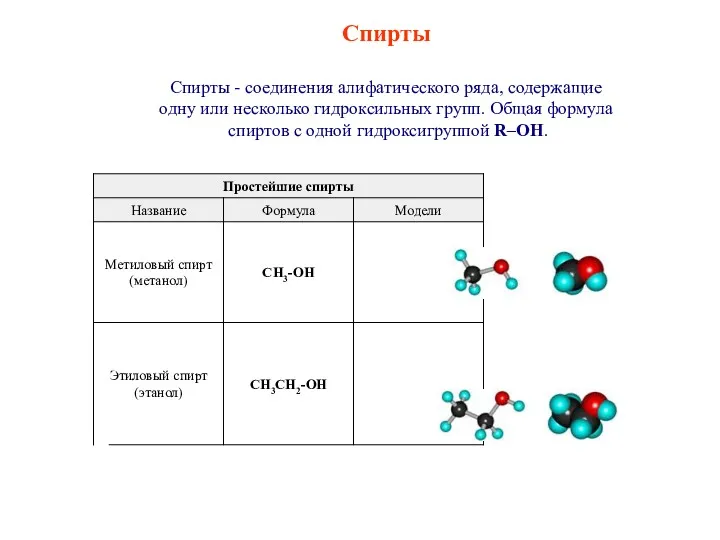 Спирты. Классификация спиртов
Спирты. Классификация спиртов Супрамолекулярные системы – мост между неживой и живой материей
Супрамолекулярные системы – мост между неживой и живой материей Типы химических реакций. Систематизация и обобщение знаний
Типы химических реакций. Систематизация и обобщение знаний Качество топлива и смазочных материалов, эффективность их использования
Качество топлива и смазочных материалов, эффективность их использования Резина. Состав и применение резины
Резина. Состав и применение резины Понятия и законы химии
Понятия и законы химии Периодические изменения свойств химических элементов
Периодические изменения свойств химических элементов кл химия Классификация химических элементов
кл химия Классификация химических элементов Основания, их классификация и свойства в свете теории электролитической диссоциации
Основания, их классификация и свойства в свете теории электролитической диссоциации Горение топлива
Горение топлива Ртуть. Применение ртути и ее соединений
Ртуть. Применение ртути и ее соединений Научные основы и технологии зеленой химии
Научные основы и технологии зеленой химии МЕТОДЫ ОЧИСТКИ НЕФТЯНЫХ ФРАКЦИЙ
МЕТОДЫ ОЧИСТКИ НЕФТЯНЫХ ФРАКЦИЙ Диеновые углеводороды
Диеновые углеводороды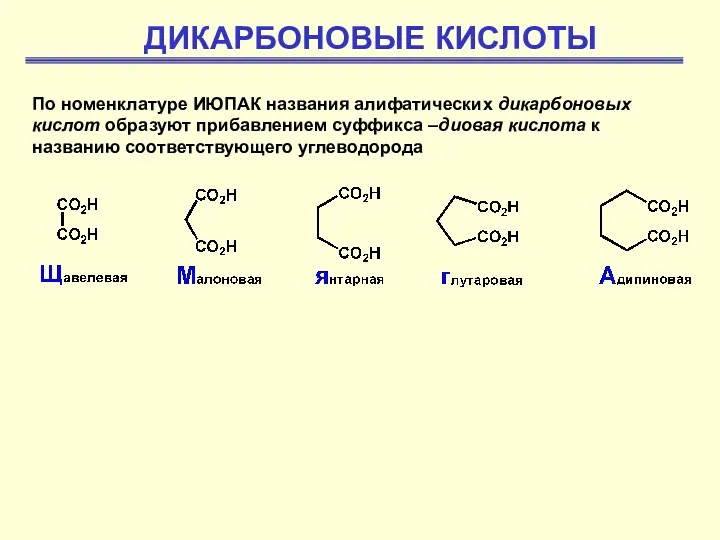 Дикарбоновые кислоты
Дикарбоновые кислоты Композиционные материалы для изоляции электрических машин
Композиционные материалы для изоляции электрических машин Степени окисления атомов и формулы веществ
Степени окисления атомов и формулы веществ Неметаллы. Обобщающий урок. 9 класс
Неметаллы. Обобщающий урок. 9 класс Crystallography. Part 4: Crystal Forms Twinning
Crystallography. Part 4: Crystal Forms Twinning Образование ионов
Образование ионов Коррозия металлов
Коррозия металлов Углепластики
Углепластики Разбор заданий
Разбор заданий Растворы ВМС
Растворы ВМС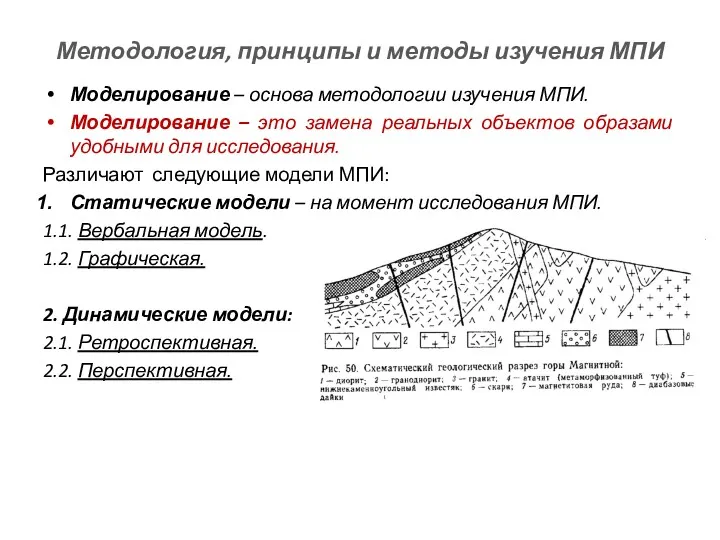 Методология, принципы и методы изучения МПИ
Методология, принципы и методы изучения МПИ Коллигативные свойства растворов неэлектролитов
Коллигативные свойства растворов неэлектролитов