Содержание
- 2. Проработать ключевые моменты изученной темы и подготовиться к контрольной работе. Цель.
- 3. 1. Систематизировать и обобщить знания особенностей строения атомов неметаллов, свойств простых веществ, а также их соединений.
- 4. Кто б ни был ты, прекрасный гений, Твои творения окажутся пустыми, Когда ты будешь сух и
- 5. Неметаллы - это химические элементы, которые образуют в свободном виде простые вещества, не обладающие физическими свойствами
- 6. Положение неметаллов в ПС Д.И.Менделеева. Неметаллы расположены в правом верхнем углу ПС (вдоль и над диагональю
- 7. Особенности атомного строения элементов-неметаллов. Для атомов-неметаллов характерно: Небольшой атомный радиус ( в сравнении с радиусами атомов-металлов
- 8. Типы кристаллических решеток неметаллов Молекулярные Атомные
- 9. Аллотропия – способность атомов одного химического элемента образовывать несколько простых веществ. Причины аллотропии: Различное число атомов
- 10. Аллотропия кислорода. Кислород и озон
- 11. Аллотропия фосфора. Красный и белый фосфор Р (красный фосфор) (белый фосфор) Р4
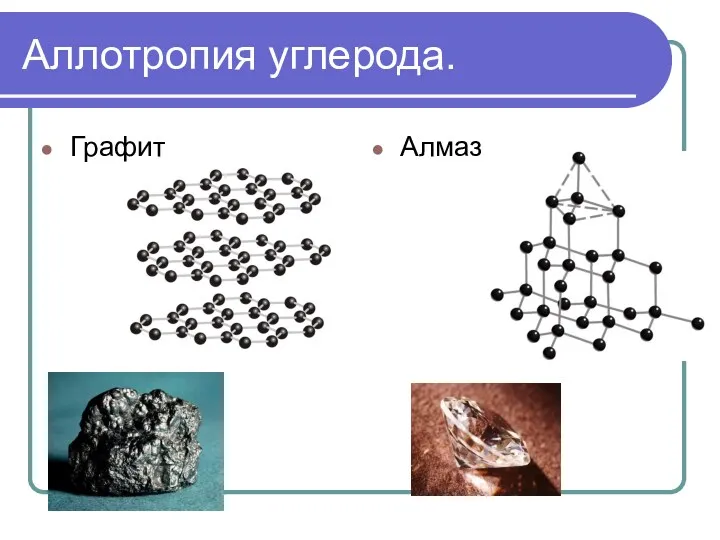
- 12. Аллотропия углерода. Графит Алмаз
- 13. Аллотропия серы. Кристаллическая, пластическая и моноклинная
- 15. Цветовая гамма неметаллов
- 16. Семен Исаакович Вольфкович (1896 – 1980) в одной из лабораторий Московского университета на Моховой получал это
- 17. У Куртуа был любимый кот, который во время обеда сидел обычно на плече своего хозяина. Куртуа
- 18. Послушайте стихотворение и переведите его на язык химии, запишите генетический ряд неметалла Пусть эти превращения Дадут
- 19. запишите генетический ряд неметалла Ответ. Генетический ряд фосфора выглядит следующим образом: Р → Р2О5 → Н3РО4
- 20. ТЕХНИКА БЕЗОПАСНОСТИ в кабинете химии
- 21. . Помните, что любое вещество может быть опасным, если обращаться с ним неправильно
- 22. Вещества не должны храниться вместе с пищевыми продуктами.
- 23. Не принимайте пищу во время химических экспериментов, а после их завершения тщательно мойте руки
- 24. Не держите пробирку отверстием к себе или к кому-нибудь, кто стоит рядом с вами.
- 25. Не склоняйтесь над сосудом с кипящей жидкостью.
- 26. Перед началом эксперимента внимательно ознакомьтесь с инструкциями
- 27. Определять запах вещества нужно очень осторожно: слегка подгоняя ладонью пары вещества в свою сторону.
- 28. Эксперименты нужно выполнять в строгом соответствии с инструкциями, используя точно указанные количества веществ
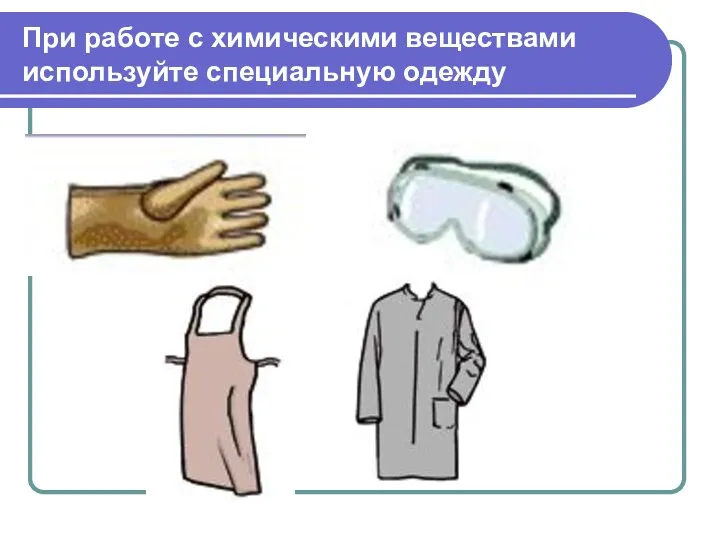
- 29. При работе с химическими веществами используйте специальную одежду
- 30. Задание Выбрав необходимые реактивы, проведите качественные реакции на ионы: «C» - CO32- «S» - SO42- «Cl»
- 31. Качественные реакции на ионы Карбонат-ион Сульфат-ион Хлорид-ион
- 32. Виртуальный эксперимент
- 33. Запишите уравнение реакции на доске и расставьте коэффициенты методом электронного баланса. Определите тип реакции по всем
- 34. Конкурс «Расчетный» Вычислите массу осадка сульфата бария, который был получен при взаимодействии 200 г. сульфата натрия,
- 35. Тест – экспресс 1. Символ элемента, образующего простое вещество — неметалл: A. Mg. Б. Сu. В.
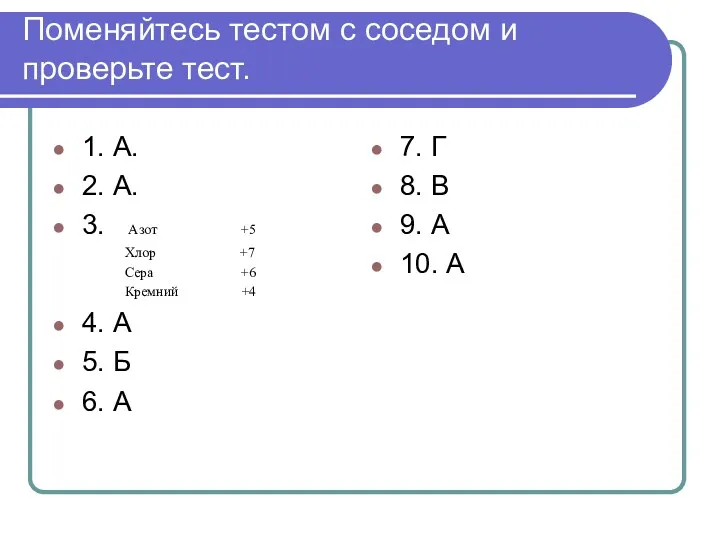
- 36. Поменяйтесь тестом с соседом и проверьте тест. 1. А. 2. А. 3. Азот +5 Хлор +7
- 37. Критерии оценок «5» - 0-1 ошибка «4» - 2-3 ошибки «3» - 4-5 ошибок «2» -
- 38. Домашнее задание составить задачу (найти объем СО2 ), повторить качественные реакции, обратить внимание на соединения азота.
- 39. Рефлексия Заканчивая урок, продолжите фразу: «Уходя с урока, я хочу сказать …» Мне было комфортно на
- 41. Скачать презентацию

































 Железо. Fe (лат. Феррум)
Железо. Fe (лат. Феррум) Узагальнення й систематизація знань з теми Початкові хімічні поняття
Узагальнення й систематизація знань з теми Початкові хімічні поняття Аминокислоты. Пептиды. Хроматографические методы исследования
Аминокислоты. Пептиды. Хроматографические методы исследования Химическая связь
Химическая связь Розв'язування задач за рівнянням хімічних реакцій
Розв'язування задач за рівнянням хімічних реакцій NaHSO4. Гидросульфат натрия
NaHSO4. Гидросульфат натрия Молекулярно-массовые характеристики высокомолекулярных соединений
Молекулярно-массовые характеристики высокомолекулярных соединений Общие проблемы определения низких концентраций
Общие проблемы определения низких концентраций Ионные уравнения
Ионные уравнения Реакции ионного обмена
Реакции ионного обмена Установка производства олефинов для синтеза линейных алкилбензолов
Установка производства олефинов для синтеза линейных алкилбензолов Практикум по органической и биоорганической химии
Практикум по органической и биоорганической химии Строение вещества. Химические элементы
Строение вещества. Химические элементы Применение солей
Применение солей Обзор электродных процессов
Обзор электродных процессов Спроби класифікації хімічних елементів
Спроби класифікації хімічних елементів Металловедение. Классификация металлов
Металловедение. Классификация металлов Физико-химические методы в анализе ЛВ. Метод ионометрии в анализе ЛВ. Определение спирта в фармацевтических препаратах
Физико-химические методы в анализе ЛВ. Метод ионометрии в анализе ЛВ. Определение спирта в фармацевтических препаратах Окислительновосстановительное титрование
Окислительновосстановительное титрование Активационный анализ
Активационный анализ Твердотільний ямр
Твердотільний ямр Карбоновые кислоты. Изомерия. Физические, химические свойства. Получение, применение
Карбоновые кислоты. Изомерия. Физические, химические свойства. Получение, применение Наноматериалы. Свойства наноматериалов. Особенности свойств
Наноматериалы. Свойства наноматериалов. Особенности свойств Карбоновые кислоты
Карбоновые кислоты Значение периодического закона и периодической системы Д.И. Менделеева
Значение периодического закона и периодической системы Д.И. Менделеева Способы получения металлов
Способы получения металлов Химическая связь
Химическая связь Закон сохранения массы вещества. Химические уравнения
Закон сохранения массы вещества. Химические уравнения