Содержание
- 2. Карбоновые кислоты - это органические соединения, в молекулах которых содержится функциональная карбоксильная группа - СООН, связанная
- 3. Классификация карбоновых кислот По числу карбоксильных групп
- 4. 2. По строению углеводородного радикала Классификация карбоновых кислот
- 5. Гомологический ряд предельных одноосновных карбоновых кислот. R-COOH Общая формула
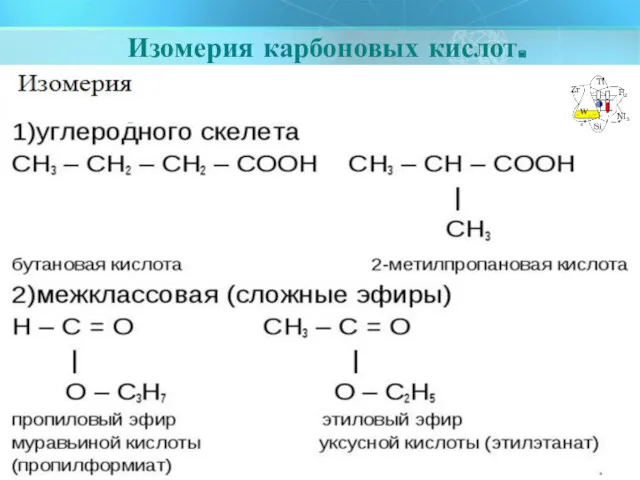
- 6. Изомерия карбоновых кислот.
- 7. Взаимное влияние атомов в молекуле В результате сильного влияния карбонильной группы на гидроксил - ОН связь
- 8. Физические свойства предельных одноосновных кислот" С1 - С8(низшие) - жидкости, запах, хорошая растворимость с С9 (высшие)
- 9. Химические свойства карбоновых кислот. 1. Действие растворимых карбоновых кислот на индикаторы Вывод: карбоновые кислоты, также, как
- 10. Общие свойства с неорганическими кислотами. Взаимодействие с активными металлами. 2СН3СООН + Mg → Mg(CH3COO)2 +H2↑ уксусная
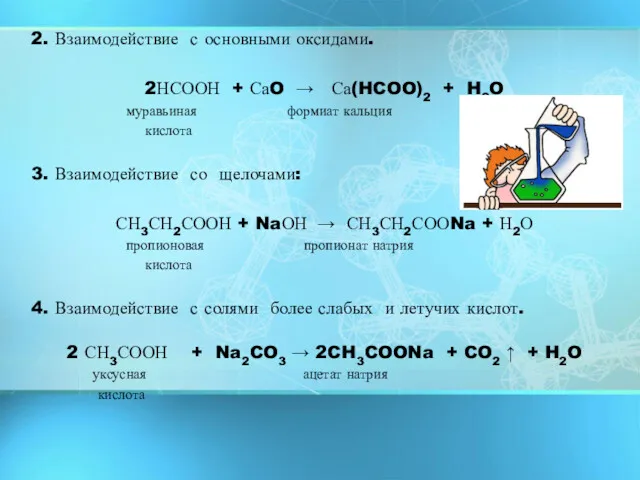
- 11. 2. Взаимодействие с основными оксидами. 2НСООН + СаO → Са(HCOO)2 + H2O муравьиная формиат кальция кислота
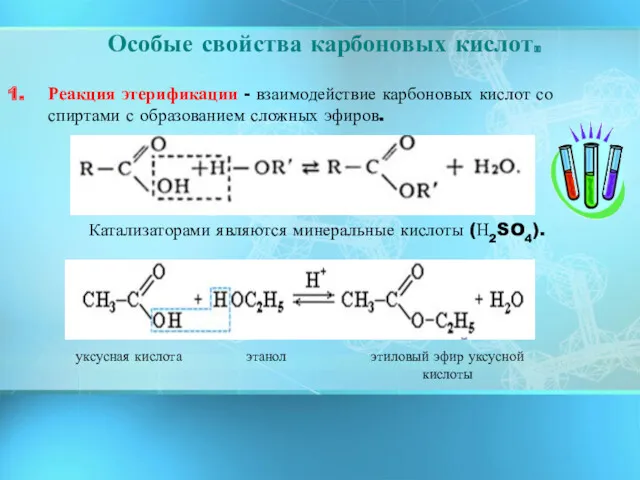
- 12. Особые свойства карбоновых кислот. Реакция этерификации - взаимодействие карбоновых кислот со спиртами с образованием сложных эфиров.
- 13. 2. Взаимодействие с галогенами. У карбоновых кислот под влиянием карбоксильной группы увеличивается подвижность атомов водорода, стоящих
- 14. Впишите в уравнениях недостающее вещество. СН3СООН + ... → СН3СООNa + H2O ... + HO -
- 15. Получение 1. Действуя на соль органической кислоты более сильной неорганической кислотой. 2 СН3 - СООNa +
- 17. Скачать презентацию











 Горение жидкого топлива
Горение жидкого топлива Соли (12 класс)
Соли (12 класс) Задачи по химии
Задачи по химии Кислоты: классификация и химические свойства
Кислоты: классификация и химические свойства Chemical reaction rate. Influence of conditions on the rate of chemical reactions. Catalysis. Topic 3.2
Chemical reaction rate. Influence of conditions on the rate of chemical reactions. Catalysis. Topic 3.2 Ступінь окиснення. Визначення ступеня окиснення елемента за хімічною формулою сполуки
Ступінь окиснення. Визначення ступеня окиснення елемента за хімічною формулою сполуки Биоразлагаемые ПАВ. Лекция 2
Биоразлагаемые ПАВ. Лекция 2 Волшебница - вода
Волшебница - вода Аминокислоты. Белки
Аминокислоты. Белки Учение о растворах. Фазовые равновесия
Учение о растворах. Фазовые равновесия Природный газ
Природный газ Дослідження швидкості росту кристалів від концентрації розчину
Дослідження швидкості росту кристалів від концентрації розчину Физико-химические свойства белков. Количественные (колориметрические) методы определения концентрации белка
Физико-химические свойства белков. Количественные (колориметрические) методы определения концентрации белка Общие свойства металлов
Общие свойства металлов Амины. Общая характеристика, номенклатура, изомерия. Получение. Физико-химические свойства. Отдельные представители
Амины. Общая характеристика, номенклатура, изомерия. Получение. Физико-химические свойства. Отдельные представители Классификация химических реакций
Классификация химических реакций Производство извести в домашних условиях. 7 класс
Производство извести в домашних условиях. 7 класс Отчет о прохождении производственно-технологической практики
Отчет о прохождении производственно-технологической практики Химическое равновесие
Химическое равновесие Химия селена и теллурар
Химия селена и теллурар Комплексні сполуки
Комплексні сполуки Теория сплавов
Теория сплавов Скорость химических реакций. Факторы, влияющие на скорость химической реакции
Скорость химических реакций. Факторы, влияющие на скорость химической реакции Розв'язування задач за рівнянням хімічних реакцій
Розв'язування задач за рівнянням хімічних реакцій Электролитическая диссоциация
Электролитическая диссоциация Гидролиз солей
Гидролиз солей Химическая связь. Электроотрицательность и полярность связи
Химическая связь. Электроотрицательность и полярность связи Вуглеводи
Вуглеводи