Содержание
- 2. Фаза и ее отличие от агрегатного состояния Правило фаз Гиббса Фазовые диаграммы однокомпонентных систем Фазовые равновесия
- 3. Гомогенная система – ТД система, внутри которой нет поверхностей раздела, отделяющих друг от друга части системы,
- 4. Твердое вещество характеризуется способностью сохранять объём и форму Жидкость характеризуется способностью сохранять объём. Жидкость принимает форму
- 5. Фаза - гомогенная часть гетерогенной системы Компонент – вещество, которое может быть выделено из системы и
- 6. С=К-Ф+N – в общем случае С=К-Ф+2 – для систем, на которые влияют Т, Р Число степеней
- 7. - графическое отображение равновесного состояния бесконечной физико-химической системы Обычными координатами для построения фазовой диаграммы являются термодинамические
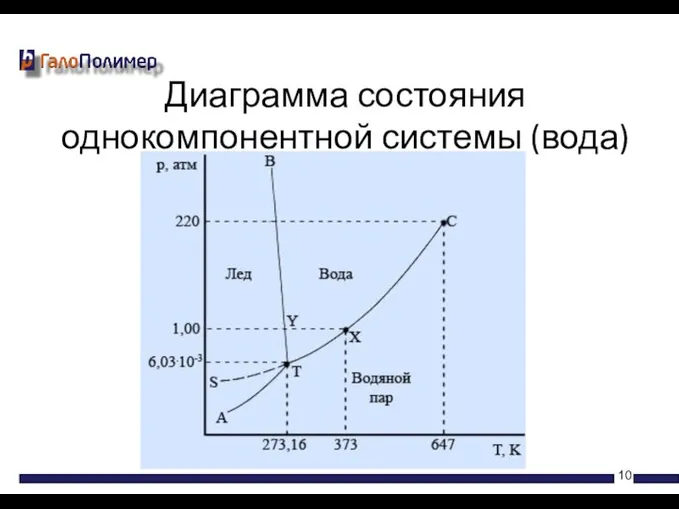
- 8. На фазовых диаграммах однокомпонентных систем поля, по правилу фаз, соответствуют однофазным состояниям, линии, разграничивающие их —
- 9. Физические явления, происходящие без протекания химических реакций: Плавление и кристаллизация (твердое вещество ↔ жидкость) Кипение (испарение)
- 10. Диаграмма состояния однокомпонентной системы (вода)
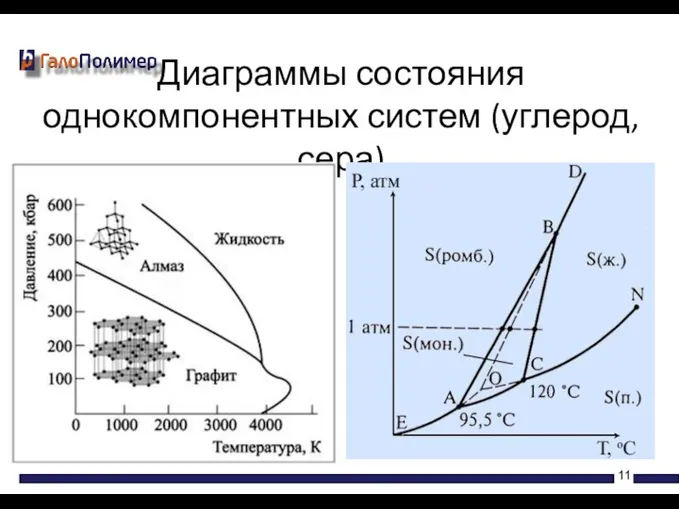
- 11. Диаграммы состояния однокомпонентных систем (углерод, сера)
- 12. Классификация растворов Виды концентрации растворов Закон Рауля и следствия из него. Коллигативные свойства растворов Термодинамика жидких
- 13. Раствор – однофазная (гомогенная) система, состоящая из двух и более веществ Растворитель – компонент раствора, находящийся
- 14. Истинный раствор – однофазная (гомогенная) система, состоящая из двух и более веществ. Например, раствор хлористого водорода
- 15. Концентрированный раствор имеет большое содержание растворенного вещества Разбавленный раствор содержит растворенное вещество в низкой концентрации Насыщенный
- 16. Массовая доля, ω равна отношению массы растворенного вещества к массе раствора. Измеряется в долях единицы (от
- 17. Объемная доля, ϕ равна отношению объема растворенного вещества к объему раствора. Измеряется в долях единицы (от
- 18. Молярная концентрация CM равна отношению количества растворенного вещества к объему раствора. Измеряется в моль/дм3 (моль/л), М.
- 19. Молярная концентрация эквивалента CН (старое название - нормальная концентрация) равна отношению количества эквивалентов растворенного вещества к
- 20. Моляльная концентрация Cm равна отношению количества растворенного вещества к массе раствора. Измеряется в моль/кг Cm =
- 21. Титр по растворённому веществу (просто титр) равен отношению массы растворённого вещества (титранта) к объему раствора. Измеряется
- 22. С какими растворами Вы сталкиваетесь в ходе работы на предприятии ООО «ГалоПолимер Кирово-Чепецк»? Для получения хлора
- 23. Давление пара растворителя над раствором меньше, чем над чистым растворителем P1=P10*X1 Относительное понижение давления пара растворителя
- 24. Понижение температуры замерзания раствора по сравнению с чистым растворителем, ΔТзам=Ккр*Cm Повышение температуры кипения раствора по сравнению
- 25. Следствия из закона Рауля (коллигативные свойства растворов)
- 26. Растворитель и растворенное вещество –летучие жидкости Разделение перегонкой (простой, фракционной, ректификацией) за счет различия Ткип Кипение
- 27. Метан CH4, Ткип= -161,5 °С Хлор Сl2, Ткип= -34,06 °С Хлористый метил CH3Cl, Ткип= -24,2 °С
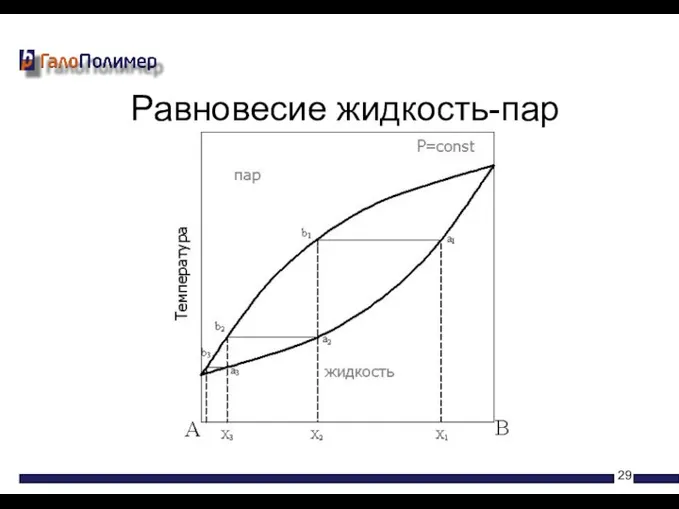
- 28. Жидкости закипают тогда, когда давление пара над ними становится равным атмосферному давлению. Чистые жидкости кипят при
- 29. Равновесие жидкость-пар
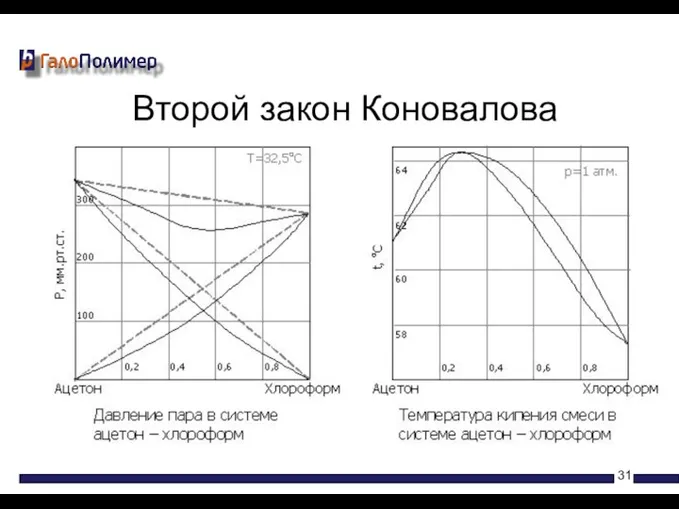
- 30. Экстремумы на диаграмме кипения соответствуют такому равновесию раствора и насыщенного пара, при котором составы обеих фаз
- 31. Второй закон Коновалова
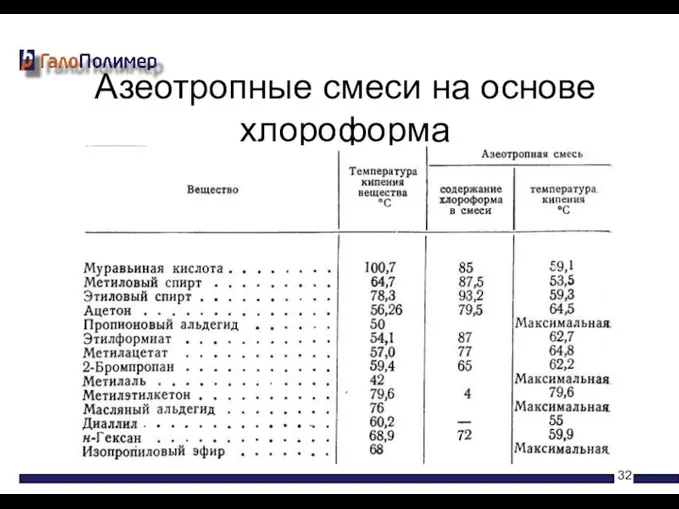
- 32. Азеотропные смеси на основе хлороформа
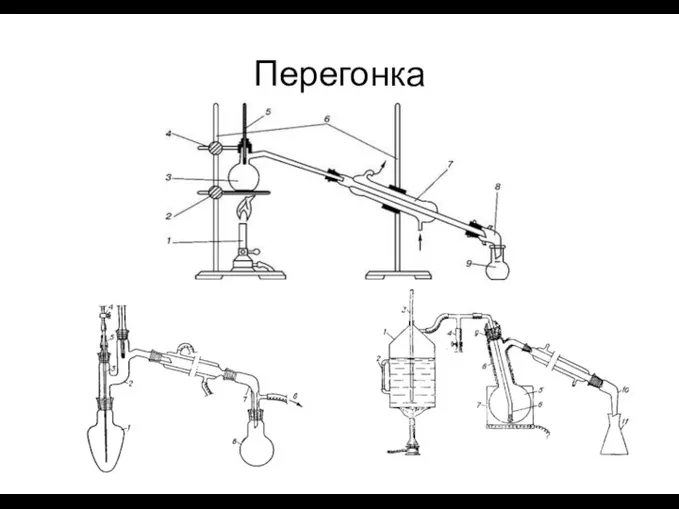
- 33. – процесс разделения жидких летучих смесей путем испарения жидкости с последующим охлаждением и конденсацией паров. Разделение
- 34. Перегонка
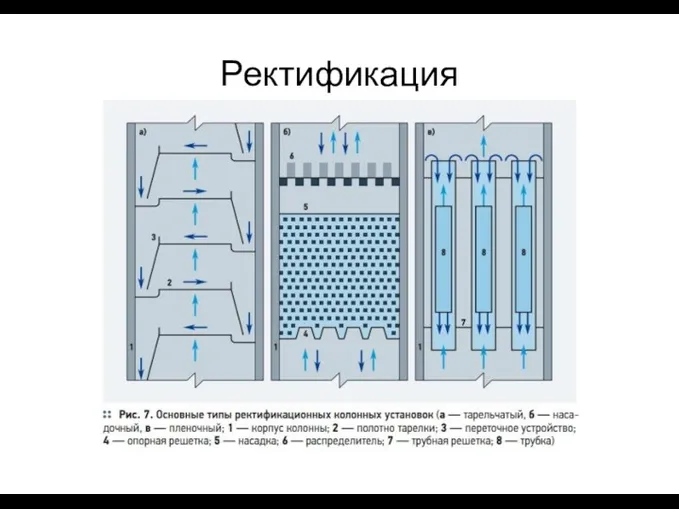
- 35. – наиболее эффективный вид дистилляции, особенность которого состоит в многократном взаимодействии пара и жидкости за счет
- 36. Ректификация
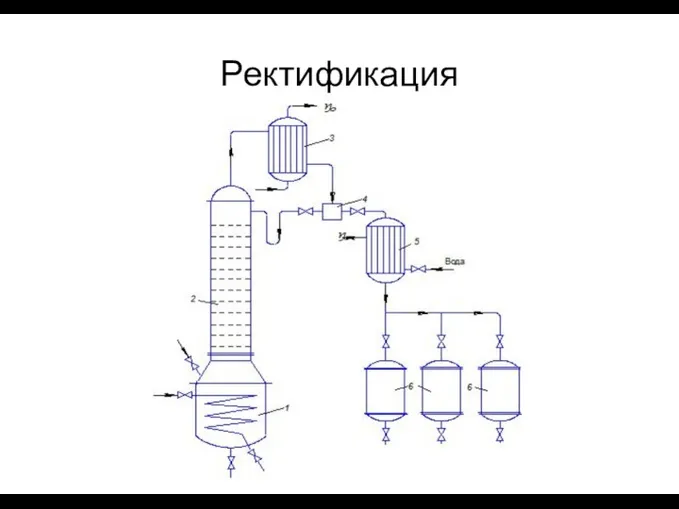
- 37. Ректификация
- 39. Скачать презентацию




























 Биогенді (s.p.d) элементтермен олардың қосылыстарының медициналық және биологиялық маңызы
Биогенді (s.p.d) элементтермен олардың қосылыстарының медициналық және биологиялық маңызы Кислоты, их состав и названия
Кислоты, их состав и названия Карбоновые кислоты и их функциональные производные
Карбоновые кислоты и их функциональные производные Ароматические углеводороды
Ароматические углеводороды Гетерофазный катализ. (Лекция 20)
Гетерофазный катализ. (Лекция 20) Горение топлива
Горение топлива Використання радіоактивних ізотопів, як індикаторів у тваринництві і археології
Використання радіоактивних ізотопів, як індикаторів у тваринництві і археології Основные классы неорганических соединений
Основные классы неорганических соединений Соли, их классификация и свойства
Соли, их классификация и свойства Органічна хімія
Органічна хімія Розв’язування задач за рівняннями реакцій з використанням розчинів із певною масовою часткою розчиненої речовини. Урок 13-14
Розв’язування задач за рівняннями реакцій з використанням розчинів із певною масовою часткою розчиненої речовини. Урок 13-14 Жёсткость воды
Жёсткость воды Полисахариды: крахмал и целлюлоза
Полисахариды: крахмал и целлюлоза Растворы. Часть 2. Лекция №7
Растворы. Часть 2. Лекция №7 Химия атмосферы. Химические процессы в тропосфере
Химия атмосферы. Химические процессы в тропосфере Буферные системы
Буферные системы Белки. Строение
Белки. Строение Классификация химических элементов. Составитель. 8 класс
Классификация химических элементов. Составитель. 8 класс Минералы для ИЗБ
Минералы для ИЗБ Концентрация растворов. Массовая доля растворенного вещества. Урок 1
Концентрация растворов. Массовая доля растворенного вещества. Урок 1 Химический элемент медь
Химический элемент медь Кинетика химических реакций
Кинетика химических реакций Кремний и его соединения
Кремний и его соединения Галогены. Расположите галогены в порядке их открытия
Галогены. Расположите галогены в порядке их открытия Важнейшие реакции в органической химии
Важнейшие реакции в органической химии Технология производства аминоальдегидных смол
Технология производства аминоальдегидных смол Углерод. Физические и химические свойства
Углерод. Физические и химические свойства Гидролиз солей
Гидролиз солей