Содержание
- 2. Место меди в Периодической системе химических элементов Д.И. Менделеева Медь расположена в 11 группе Периодической системы
- 3. Физические свойства меди Медь – пластичный, розовато-красный металл с металлическим блеском. Обладает высокой тепло- и электропроводностью,
- 4. Химические свойства меди С кислородом в зависимости от температуры взаимодействия медь образует два оксида: 2Cu +
- 5. Взаимодействие с аммиаком Медь растворяется в водном растворе аммиака в присутствии кислорода воздуха с образованием гидроксида
- 6. Восстановительные свойства Медь окисляется оксидом азота (IV) и хлоридом железа (III): 2Cu + NO2 = Cu2O
- 7. Взаимодействие с кислотами В электрохимическом ряду напряжений металлов медь расположена после водорода, поэтому она не взаимодействует
- 8. Медь — один из первых металлов, широко освоенных человеком из-за сравнительной доступности для получения и малой
- 9. Нахождение в природе. Медь встречается в природе как в соединениях, так и в самородном виде. Нередко
- 10. Физические свойства Медь — золотисто-розовый пластичный металл, на воздухе быстро покрывается оксидной плёнкой. Медь обладает высокой
- 11. Применение Медь широко применяется в электротехникеМедь широко применяется в электротехнике для изготовления силовых кабелей, проводов или
- 12. Медь широко используется для производства медных труб применяющихся для транспортировки жидкостей и газов В разнообразных областях
- 13. Ювелирные сплавы В ювелирном деле часто используются сплавы меди с золотом для увеличения прочности изделий к
- 14. Широко применяется медь в архитектуре. Кровли и фасады из тонкой листовой меди из-за автозатухания процесса коррозии
- 15. Биологическая роль Медь - необходимый элемент для высших растений и животных. После усваивания меди кишечникомПосле усваивания
- 16. Влияние на экологию При открытом способе добычи меди, после её прекращения карьер становится источником токсичных веществ.
- 18. Скачать презентацию















 Процессы проявления и фиксирования
Процессы проявления и фиксирования Периодическая система химических элементов. Периоды
Периодическая система химических элементов. Периоды Непредельные углеводороды: общая характеристика
Непредельные углеводороды: общая характеристика Көмірсутектерді пиролиздеу арқылы қарапайым олефиндерді алу
Көмірсутектерді пиролиздеу арқылы қарапайым олефиндерді алу Скорость химических реакций. Факторы, влияющие на скорость химической реакции
Скорость химических реакций. Факторы, влияющие на скорость химической реакции Растворимость веществ в воде. Растворы. 8 класс
Растворимость веществ в воде. Растворы. 8 класс Валентность химических элементов
Валентность химических элементов Химическое равновесие. Принцип Ле Шателье
Химическое равновесие. Принцип Ле Шателье Закономірності протікання хімічних реакцій
Закономірності протікання хімічних реакцій Атомы, молекулы и ионы
Атомы, молекулы и ионы Химия нефти и газа
Химия нефти и газа Кислород
Кислород Відкриття та походження хімічних елементів
Відкриття та походження хімічних елементів Чистые вещества и смеси (продолжение)
Чистые вещества и смеси (продолжение) Кондуктометрия. Кондуктометрия әдісі. Электрохимиялық әдістер
Кондуктометрия. Кондуктометрия әдісі. Электрохимиялық әдістер Поліметилметакрилат
Поліметилметакрилат Скорость химических реакций. Факторы, влияющие на скорость химической реакции
Скорость химических реакций. Факторы, влияющие на скорость химической реакции Хімія у побуті
Хімія у побуті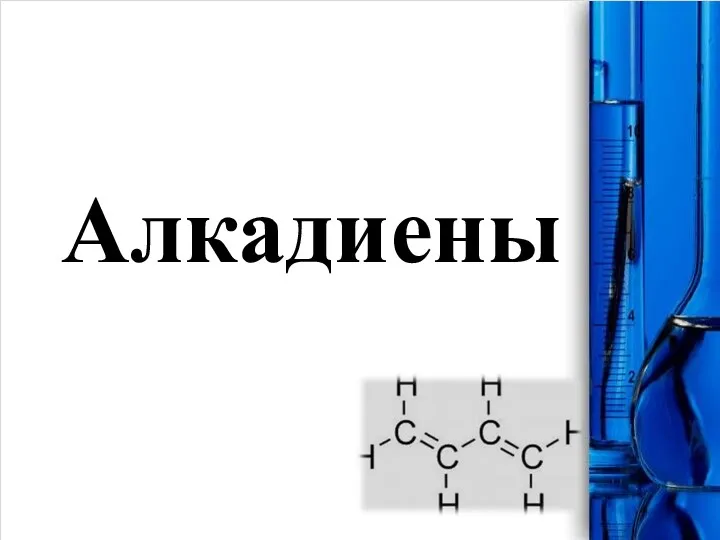 Алкадиены
Алкадиены Коррозия металлов и способы защиты от неё
Коррозия металлов и способы защиты от неё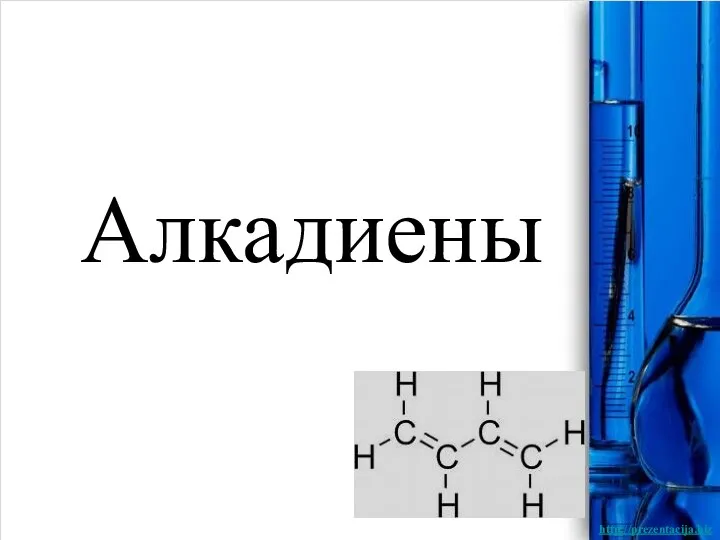 Алкадиены
Алкадиены Закон сохранения массы веществ
Закон сохранения массы веществ Полимеры. Пластмассы. Волокна
Полимеры. Пластмассы. Волокна Методы количественного определения. Химические методы анализа
Методы количественного определения. Химические методы анализа Техники ювелирного дела. Введение в предмет. Общие сведения
Техники ювелирного дела. Введение в предмет. Общие сведения Vitaminele
Vitaminele Пробоотбор других ООС. Лекция 3
Пробоотбор других ООС. Лекция 3 Химический состав клетки. Неорганические вещества клетки. Урок 1
Химический состав клетки. Неорганические вещества клетки. Урок 1