Содержание
- 2. План: Скорость химической реакции Гетерогенные и гомогенные реакции Зависимость скорости реакции от различных факторов: Природа реагирующих
- 3. Скорость химической реакции Обозначается ν 1 моль/л∙с 1 кмоль/м3∙мин определяется изменением концентрации одного из реагирующих веществ
- 4. Раздел химии, изучающий скорость химической реакции, называется химической кинетикой.
- 5. Гетерогенные реакции Это реакции идущие между веществами в неоднородной среде. Например, на поверхности соприкосновения твердого вещества
- 6. Гомогенные реакции Это реакции протекающие в однородной среде(нет поверхности раздела реагирующих веществ). Например в смеси газов
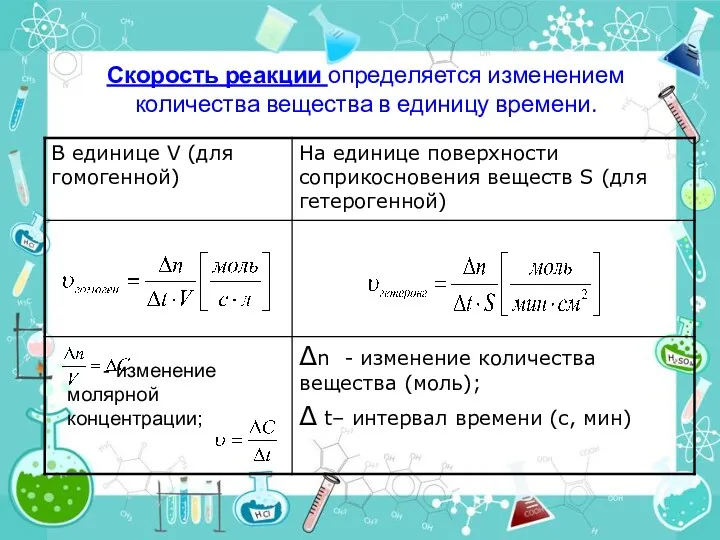
- 7. Скорость реакции определяется изменением количества вещества в единицу времени. - изменение молярной концентрации;
- 8. Задача на применение знаний по «Скорости химических реакций» Химическая реакция протекает в растворе, согласно уравнению: А+В
- 9. Самопроверка.
- 10. Факторы, влияющие на скорость химической реакции природа реагирующих веществ; концентрация реагирующих веществ поверхность соприкосновения реагирующих веществ
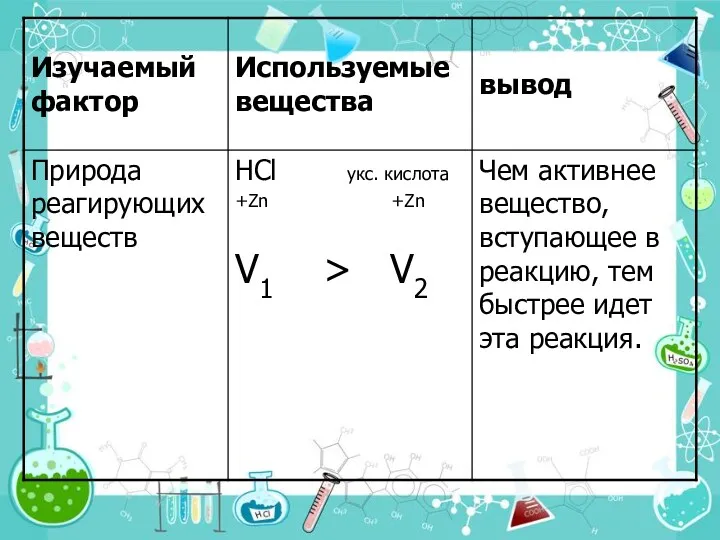
- 11. 1. Природа реагирующих веществ. Под природой реагирующих веществ понимают их состав, строение, взаимное влияние атомов в
- 12. Теория столкновений. Основная идея теории: реакции происходят при столкновении частиц реагентов, которые обладают определённой энергией. Чем
- 14. Задание на применение знаний Объясните разную скорость взаимодействия цинка с соляной и уксусной кислотой. (видеоопыт) Напишите
- 15. Самопроверка __HCl + __Zn __ZnCl2 + __H2 Сильная кислота __СH3COOH + __ Zn __CH3COOZn + __H2
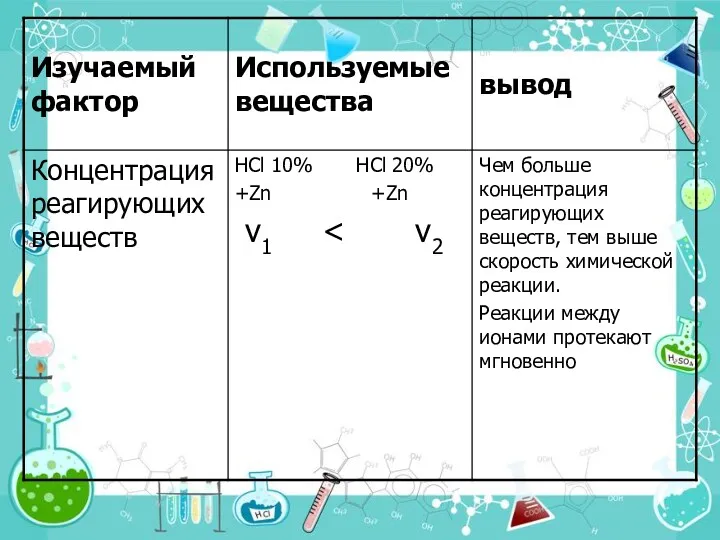
- 16. 2. Концентрации реагирующих веществ. На основе большого экспериментального материала в 1867 г. норвежские учёные К. Гульдберг,
- 17. Закон действующих масс. Гульдберг (1836-1902). Норвежский физикохимик. П. Вааге (1833-1900). Норвежский ученый. V=kcAacBb Скорость химической реакции
- 19. Математическое выражение закона действующих масс. По закону действующих масс скорость реакции, уравнение которой А+В=С может быть
- 20. Задача на применение знаний: Задача. Как изменится скорость реакции, имеющей кинетическое уравнение v= kCA 2CB, если
- 21. Самопроверка. Решение. Подставим соответствующие данные в кинетическое уравнение, сравним скорости реакций. а) скорость реакции увеличится в
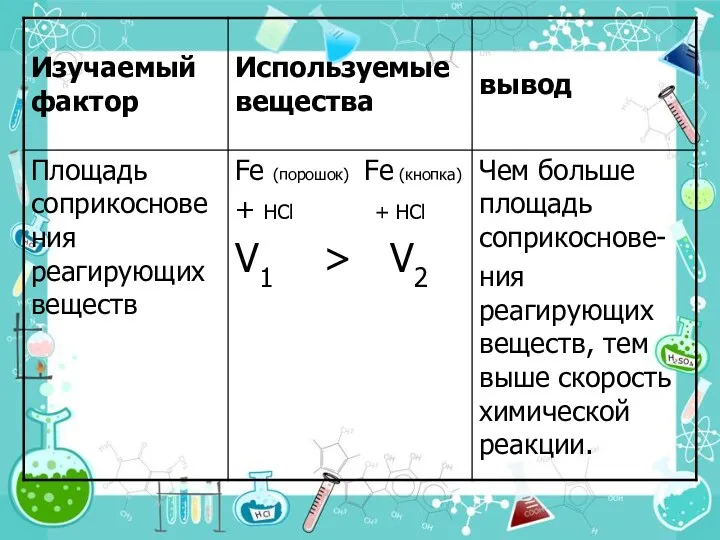
- 22. 3.Поверхность соприкосновения реагирующих веществ. Скорость реакции увеличивается благодаря: -увеличению площади поверхности соприкосновения реагентов (измельчение); -повышению реакционной
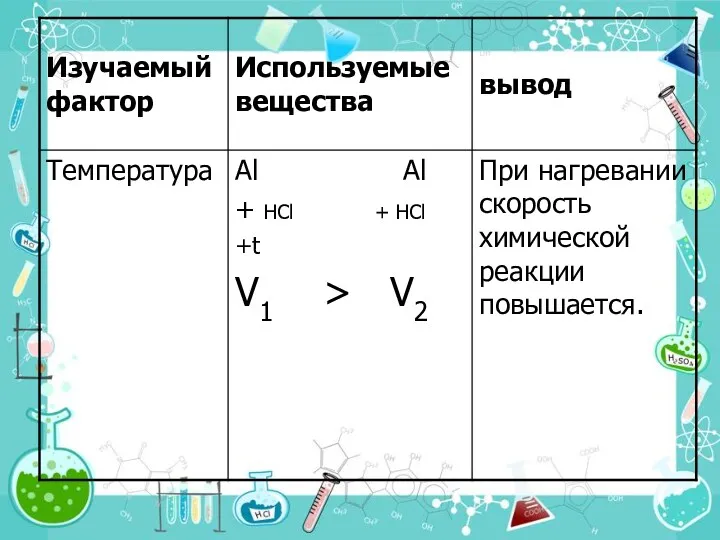
- 24. 4. Температура При увеличении температуры на каждые 10° С общее число столкновений увеличивается только на ~
- 25. Правило Вант-Гоффа Я. Вант-Гофф (1852 -1911). Голландский химик. Один из основателей физической химии и стереохимии При
- 27. Задача на применение знаний: Определите, как изменится скорость некоторой реакции: а) при повышении температуры от 10°
- 28. Самопроверка а) подставить данные задачи в формулу: скорость реакции увеличится в 81 раз. б) Скорость реакции
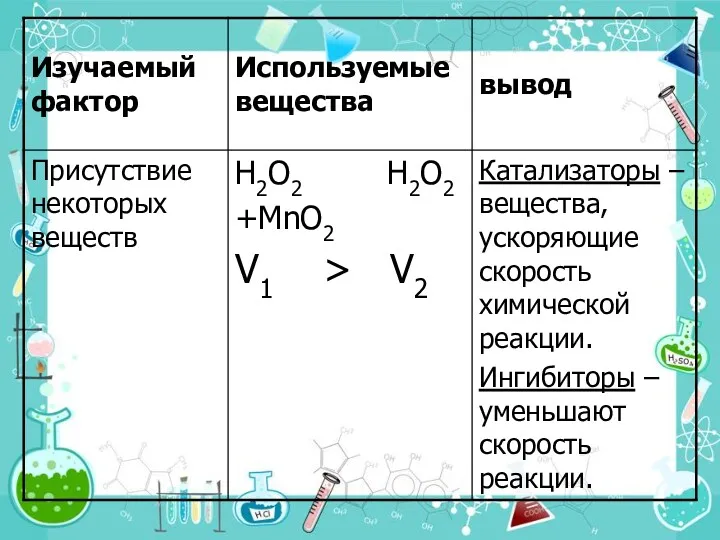
- 29. 5. Действие катализатора Можно изменить скорость реакции, используя специальные вещества, которые изменяют механизм реакции и направляют
- 30. Различают два вида катализа: Гомогенный катализ, при котором и катализатор, и реагирующие вещества находятся в одном
- 33. Скачать презентацию
























 Химические свойства металлов
Химические свойства металлов Золото. Что о нём мы можем рассказать?
Золото. Что о нём мы можем рассказать? d-элементы
d-элементы Подготовка к ВПР по химии. 11 класс
Подготовка к ВПР по химии. 11 класс Метаболизм кетоновых тел. Метаболизм холестерина
Метаболизм кетоновых тел. Метаболизм холестерина Химический потенциал. Фазовые равновесия
Химический потенциал. Фазовые равновесия Кислотные дожди
Кислотные дожди The Molecules of Life
The Molecules of Life Цинк и его соединения
Цинк и его соединения Фосфор и его соединения
Фосфор и его соединения Химия воды
Химия воды Закономірності протікання хімічних реакцій
Закономірності протікання хімічних реакцій Классификация химических элементов
Классификация химических элементов Способы выражения состава раствора. Задача 7
Способы выражения состава раствора. Задача 7 НЮ 2.1.1. Металлы - общая характеристика
НЮ 2.1.1. Металлы - общая характеристика Гониометрическое исследование кристаллов
Гониометрическое исследование кристаллов Сплавы железа с углеродом: стали и чугуны
Сплавы железа с углеродом: стали и чугуны Багатоатомні насичені спирти. Фізичні та хімічні властивості. Добування і застосування
Багатоатомні насичені спирти. Фізичні та хімічні властивості. Добування і застосування Мінерали та гірські породи
Мінерали та гірські породи Серная кислота
Серная кислота Electrolysis
Electrolysis Вещества
Вещества Карбон қышқылдары, жіктелуі, сипаттамалары, таралуы
Карбон қышқылдары, жіктелуі, сипаттамалары, таралуы Аминокислоты 2
Аминокислоты 2 Метаболизм углеводов
Метаболизм углеводов Спектральные методы: атомная спектроскопия
Спектральные методы: атомная спектроскопия Валентность и степень окисления. Химическая связь
Валентность и степень окисления. Химическая связь Альдегіди. Карбонові кислоти. Одержання. Фізичні та хімічні властивості
Альдегіди. Карбонові кислоти. Одержання. Фізичні та хімічні властивості