Содержание
- 2. До бгатоатомних спиртів належать спирти із двома і більше гідроксильними групами (ОН). Загальна формула: CnH2n(OH)2 –
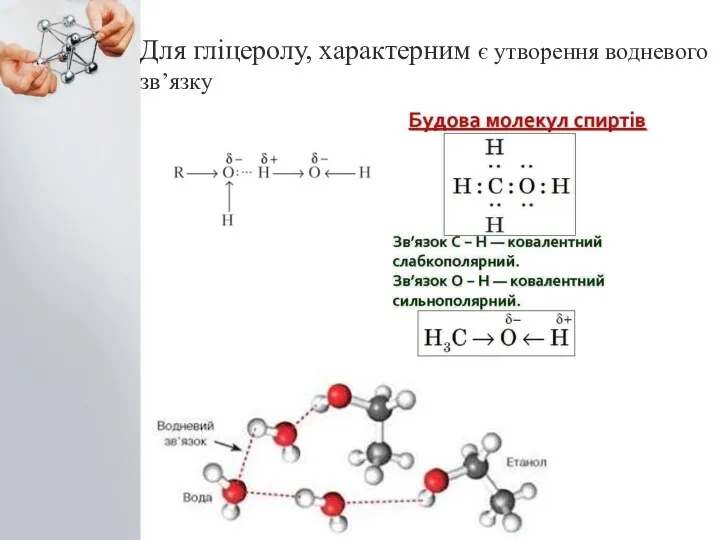
- 3. Для гліцеролу, характерним є утворення водневого зв’язку
- 4. Представники Етиленгліколь Гліцерол (гліцерин, олійний цукор) (етандіол, 1,2-етандіол) (пропантріол, 1,2,3-пропантріол) С2Н4(ОН)2 С3Н5(ОН)3 С2Н6О2 С3Н8О3 1,2,3-пропантріол 1,2-етандіол
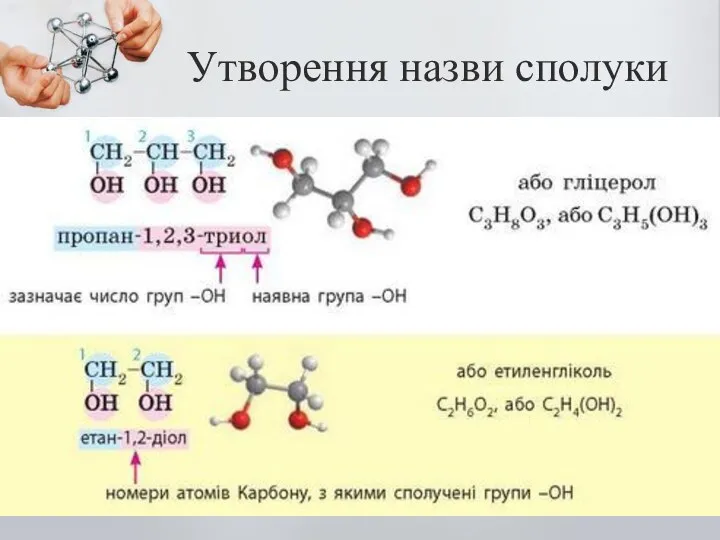
- 5. Утворення назви сполуки
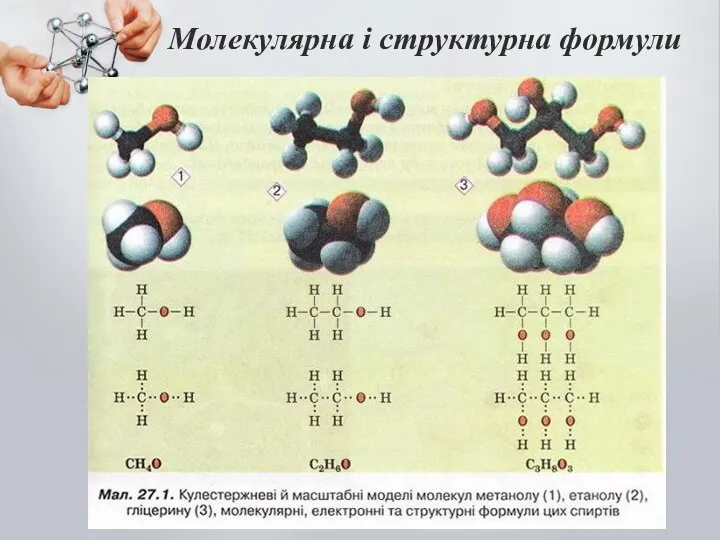
- 6. Молекулярна і структурна формули
- 7. Фізичні властивості Етиленгліколь: Безбарвна, в’язка рідина; Солодкий на смак; Температура плавлення – 11,5℃; Температура кипіння –
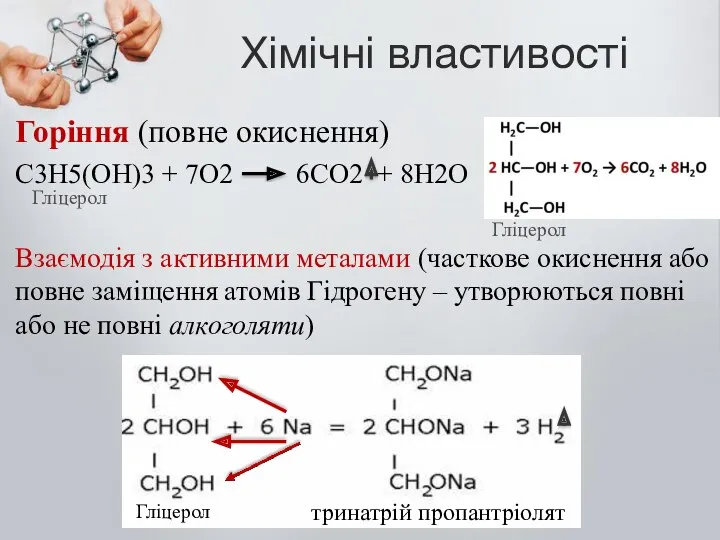
- 8. Хімічні властивості Горіння (повне окиснення) С3Н5(ОН)3 + 7О2 6СО2 + 8Н2О Взаємодія з активними металами (часткове
- 9. Хімічні властивості Взаємодія з активними металами (часткове окиснення або повне заміщення атомів Гідрогену – утворюються повні
- 10. Заміщення одного атому Гідрогену Натрієм утворює – мононатрій пропантріолят Заміщення двох томів Гідрогену Натрієм утворює –
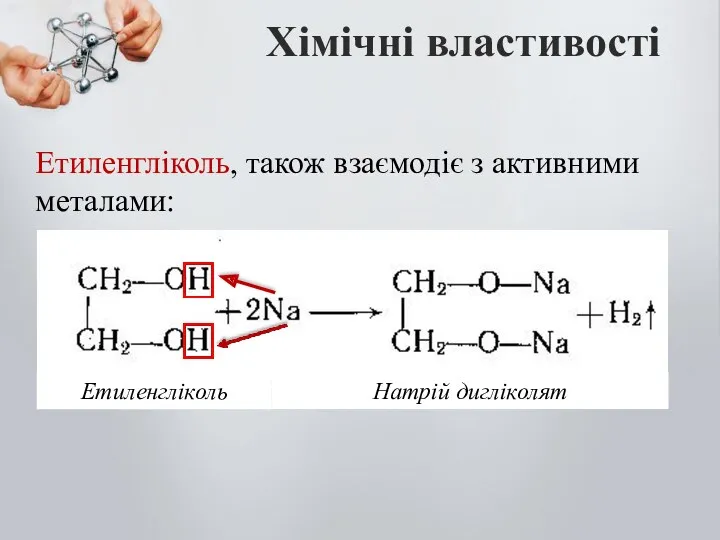
- 11. Хімічні властивості Етиленгліколь, також взаємодіє з активними металами: Натрій дигліколят Етиленгліколь
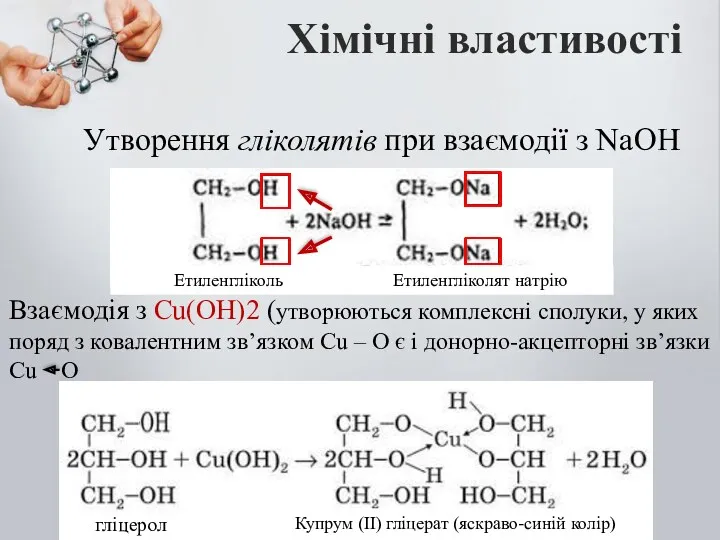
- 12. Утворення гліколятів при взаємодії з NaOH Хімічні властивості Взаємодія з Cu(OH)2 (утворюються комплексні сполуки, у яких
- 13. Взаємодія з Cu(OH)2 – це якісна реакція на багатоатомні спирти. Купрум гліцерат, що утворився – розчин
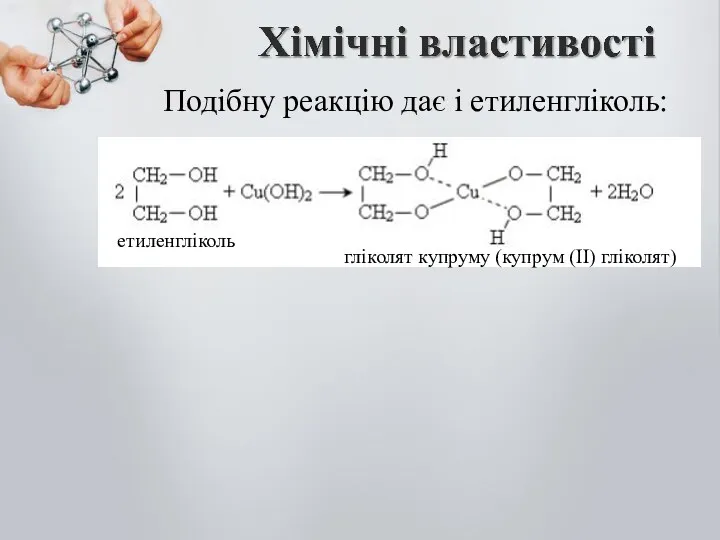
- 14. Подібну реакцію дає і етиленгліколь: етиленгліколь гліколят купруму (купрум (ІІ) гліколят)
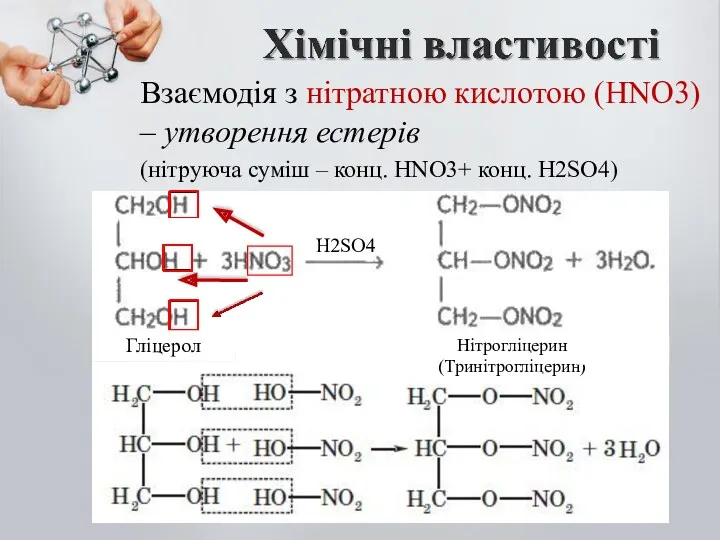
- 15. Взаємодія з нітратною кислотою (HNO3) – утворення естерів (нітруюча суміш – конц. HNO3+ конц. H2SO4) H2SO4
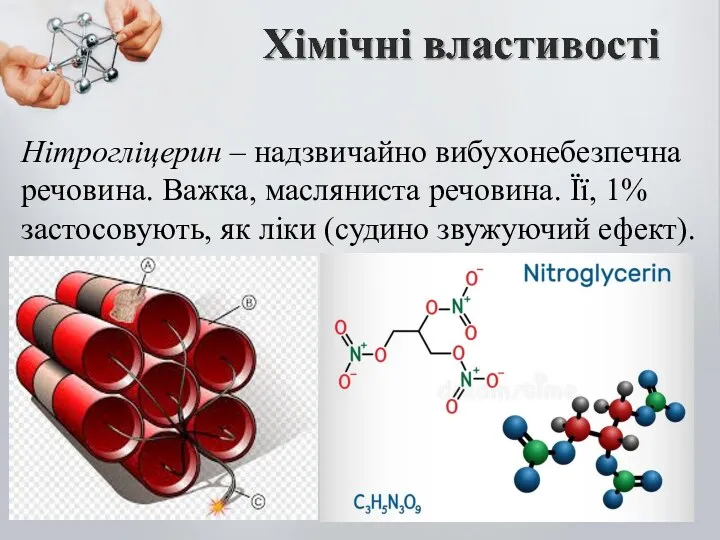
- 16. Нітрогліцерин – надзвичайно вибухонебезпечна речовина. Важка, масляниста речовина. Її, 1% застосовують, як ліки (судино звужуючий ефект).
- 17. Взаємодія з галогеноводнями (гідрогенгалогенідами) Як правило, заміщення відбувається у першій гідроксильній групі. Заміщення другої гідроксильної групи
- 18. Взаємодія з вищими карбоновими кислотами (реакція естерифікації) Трипальмітин (жир) Пальмітинова кислота Гліцерол
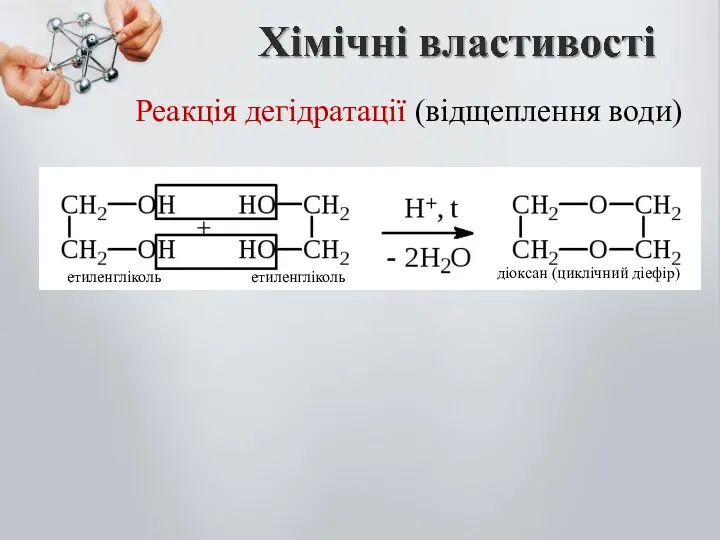
- 19. Реакція дегідратації (відщеплення води) діоксан (циклічний діефір) етиленгліколь етиленгліколь
- 20. Способи одержання Вперше гліцерин отриманий з оливкового масла хіміком і фармацевтом К. В. Шеєле в 1799
- 21. Способи одержання Лабораторні методи: Окиснення алкенів: Етиленгліколь можна отримати гідролізом дігалогеналканів. Так, при гідролізі 1, 2-дихлоретану
- 22. Промислові методи: Гідроліз жирів Промисловим способом отримання гліцерину є гідроліз жирів. В процесі гідролізу жирів утворюється
- 23. Етиленгліколь синтезують із етилену різними способами:
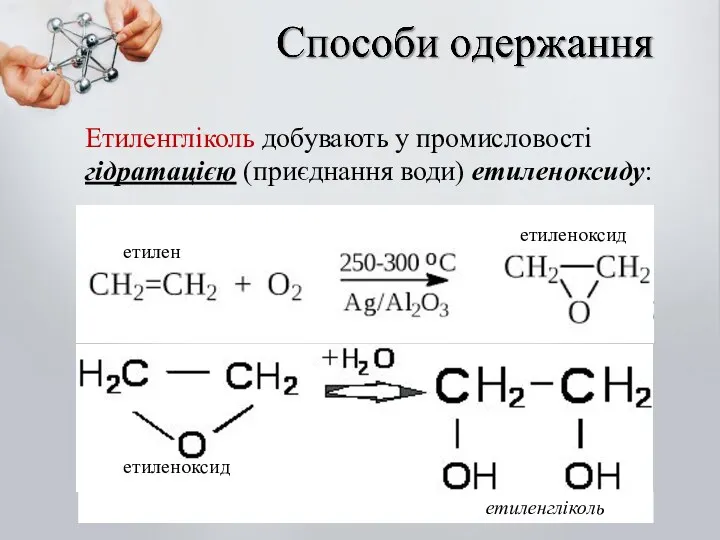
- 24. Етиленгліколь добувають у промисловості гідратацією (приєднання води) етиленоксиду: етилен етиленоксид етиленоксид етиленгліколь
- 25. Гліцерол добувають синтетично з пропілену (C3H6) за такою схемою: CH2═CH – CH3 →CH2═CH – CH2OH →
- 26. Етиленгліколь можна добути гідролізом галогенопохідних алканів водним розчином лугів. Для цієї реакції необхідні 1,2-дигалогенопохідні етану: 1,2-дихлоретан
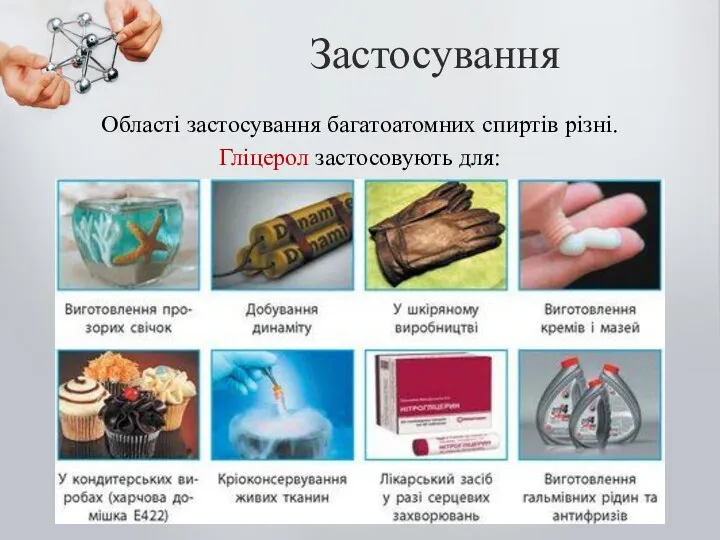
- 27. Застосування Області застосування багатоатомних спиртів різні. Гліцерол застосовують для:
- 28. Застосування
- 30. Скачать презентацию















 Природные источники углеводородов
Природные источники углеводородов Застосування неметалів
Застосування неметалів Пластмассы в автомобилестроении
Пластмассы в автомобилестроении Спирты & Фенолы
Спирты & Фенолы Химическая очистка сточных вод. Окисление и восстановление
Химическая очистка сточных вод. Окисление и восстановление Относительные атомные и молекулярные массы
Относительные атомные и молекулярные массы Физические свойства минералов
Физические свойства минералов Органическая химия. ДО. Глицерин как представитель многоатомных спиртов
Органическая химия. ДО. Глицерин как представитель многоатомных спиртов Коллоидные ПАВ. Мицеллообрaзование в растворах коллоидных ПАВ. Солюбилизация
Коллоидные ПАВ. Мицеллообрaзование в растворах коллоидных ПАВ. Солюбилизация Плотность нефти и нефтепродуктов
Плотность нефти и нефтепродуктов Соли. 11 класс
Соли. 11 класс Минерал турмалин
Минерал турмалин Основания. Гидроксид аммония-NH₃·H₂O
Основания. Гидроксид аммония-NH₃·H₂O Элемент цинк
Элемент цинк Дисперсные (коллоидные) системы и растворы
Дисперсные (коллоидные) системы и растворы Неравновесные явления в сложных химических процессах. Часть 1: электрохимия
Неравновесные явления в сложных химических процессах. Часть 1: электрохимия Химический элемент вольфрам
Химический элемент вольфрам Растворы ВМС
Растворы ВМС Chem reactions. Different Typesof Chemical Reactions
Chem reactions. Different Typesof Chemical Reactions Ферменты и гормоны. (10-11 класс)
Ферменты и гормоны. (10-11 класс) Розв’язування експериментальних задач (9 клас)
Розв’язування експериментальних задач (9 клас) Мембранный транспорт ионов: электродиффузионная теория
Мембранный транспорт ионов: электродиффузионная теория Алкины. Номенклатура и изомерия
Алкины. Номенклатура и изомерия Первые шаги в минералогию: от новичка до знатока
Первые шаги в минералогию: от новичка до знатока Складні білки
Складні білки Витамин С. Физико-химические свойства витамина С
Витамин С. Физико-химические свойства витамина С Пластмаси, синтетичні каучуки, гума, штучні й синтетичні
Пластмаси, синтетичні каучуки, гума, штучні й синтетичні Көмірсутектерді пиролиздеу арқылы қарапайым олефиндерді алу
Көмірсутектерді пиролиздеу арқылы қарапайым олефиндерді алу