Содержание
- 2. Вольфра́м — химический элемент с атомным номером 74 в периодической системе, обозначается символом W (лат. Wolframium),
- 3. Название Wolframium перешло на элемент с минерала вольфрамит, известного ещё в XVI в. под названием «волчья
- 4. Наиболее крупными запасами обладают Казахстан, Китай, Канада и США; известны также месторождения в Боливии, Португалии, России
- 5. Процесс получения вольфрама проходит через подстадию выделения триоксида WO3 из рудных концентратов и последующем восстановлении до
- 6. Вольфрам — светло-серый металл, имеющий самые высокие доказанные температуры плавления и кипения (предполагается, что сиборгий ещё
- 7. Валентность от 2 до 6. Наиболее устойчив 6-валентный вольфрам. 3- и 2-валентные соединения вольфрама неустойчивы и
- 8. Нить накаливания Тугоплавкость и пластичность вольфрама делают его незаменимым для нитей накаливания в осветительных приборах, а
- 9. Сплавы вольфрама, ввиду его высокой температуры плавления, получают методом порошковой металлургии. Сплавы, содержащие вольфрам, отличаются жаропрочностью,
- 11. Для механической обработки металлов и неметаллических конструкционных материалов в машиностроении (точение, фрезерование, строгание, долбление), бурения скважин,
- 12. Трехокись вольфрама находит применение для производства твердого электролита высокотемпературных топливных элементов. Некоторые соединения вольфрама применяются как
- 13. Искусственный радионуклид 185W используется в качестве радиоактивной метки при исследованиях вещества. Стабильный 184W используется как компонент
- 14. Цены на металлический вольфрам чистотой около 99 % на конец 2010 года составляли около 40-42 долларов
- 15. Вольфрам не играет значительной биологической роли. У некоторых архебактерий и бактерий имеются ферменты, включающие вольфрам в
- 16. Природный вольфрам состоит из пяти изотопов (180W, 182W, 183W, 184W и 186W). Искусственно созданы и идентифицированы
- 17. Вольфрам — самый тугоплавкий металл. Температура плавления 3380 °C, кипения 5900 °C. Плотность вольфрама почти равняется
- 19. Скачать презентацию















 Кислородсодержащие органические соединения
Кислородсодержащие органические соединения Соединения щелочных металлов
Соединения щелочных металлов Об изучении окислительно-восстановительных реакций в школьном курсе химии. Степени окисления атомов и формулы веществ
Об изучении окислительно-восстановительных реакций в школьном курсе химии. Степени окисления атомов и формулы веществ Відносна молекулярна маса речовини, її обчислення за хімічною формулою
Відносна молекулярна маса речовини, її обчислення за хімічною формулою Алканы
Алканы Химические свойства основных классов неорганических веществ
Химические свойства основных классов неорганических веществ Дистиляттағы цианидтер, алифаттық қатардағы галоген туындылары, хлороформ, хлоралгидрат, төртхлорлы көміртек
Дистиляттағы цианидтер, алифаттық қатардағы галоген туындылары, хлороформ, хлоралгидрат, төртхлорлы көміртек Углеводородное сырье: способы переработки
Углеводородное сырье: способы переработки Предельные углеводороды
Предельные углеводороды Комплесные соединения
Комплесные соединения Мұнай. Мұнайдың шығу тарихы
Мұнай. Мұнайдың шығу тарихы Лекция 1. Периодический закон и периодическая система химических элементов. Индустрия красоты
Лекция 1. Периодический закон и периодическая система химических элементов. Индустрия красоты Салыстырмалы тығыздығы мен элементтердің массалық үлестері бойынша газ күйіндегі заттардың молекулалық формулаларын табу
Салыстырмалы тығыздығы мен элементтердің массалық үлестері бойынша газ күйіндегі заттардың молекулалық формулаларын табу Алкалоидтар түсінігі. Никотин, кофеин,морфин, хинин туралы түсініктер
Алкалоидтар түсінігі. Никотин, кофеин,морфин, хинин туралы түсініктер Неметаллические материалы, используемые в машино- и приборостроении
Неметаллические материалы, используемые в машино- и приборостроении Спирти. 3агальна характеристика спиртів
Спирти. 3агальна характеристика спиртів Алюминий и его соединения
Алюминий и его соединения Метаболизм нуклеиновых кислот
Метаболизм нуклеиновых кислот Азотистые гетероциклические соединения
Азотистые гетероциклические соединения Формы минералов и их агрегатов
Формы минералов и их агрегатов Химические свойства металлов
Химические свойства металлов Що ховається за цифрами? Харчові домішки
Що ховається за цифрами? Харчові домішки Адсорбция-фазалар бөлу беттерінде жүретін бір компоненттің екінші компонентке сіңуі
Адсорбция-фазалар бөлу беттерінде жүретін бір компоненттің екінші компонентке сіңуі Угарный газ
Угарный газ Контрольная работа по дисциплине Физическая химия. Раздел: Электрохимия
Контрольная работа по дисциплине Физическая химия. Раздел: Электрохимия Адсорбция. Разделение однородных и неоднородных смесей
Адсорбция. Разделение однородных и неоднородных смесей Ферум та його сполуки
Ферум та його сполуки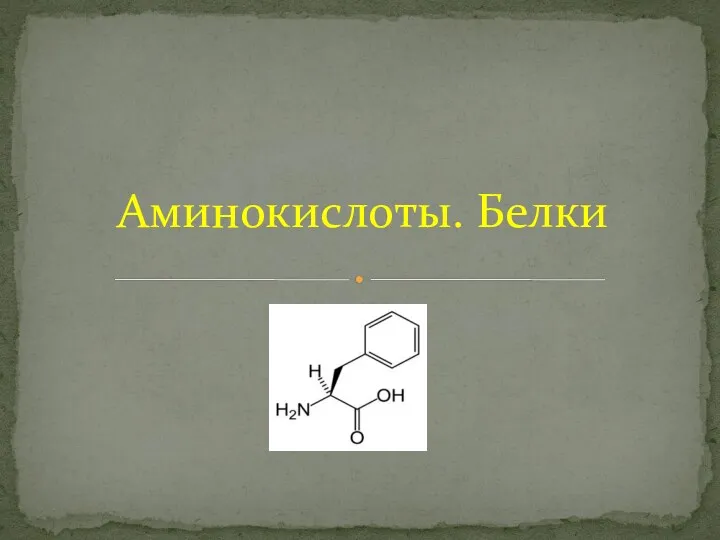 Аминокислоты. Белки
Аминокислоты. Белки