Содержание
- 2. Проверочная работа. Вариант № 1 Вариант№ 2 Напишите строение атома Na. Как изменяются восстановительные свойства щелочных
- 3. Оксиды ЩМ (Ме2О) Получают прокаливанием пероксидов с соответствующими металлами: Na2O2 + 2Na 2Na2O 2O-1 + 2e-
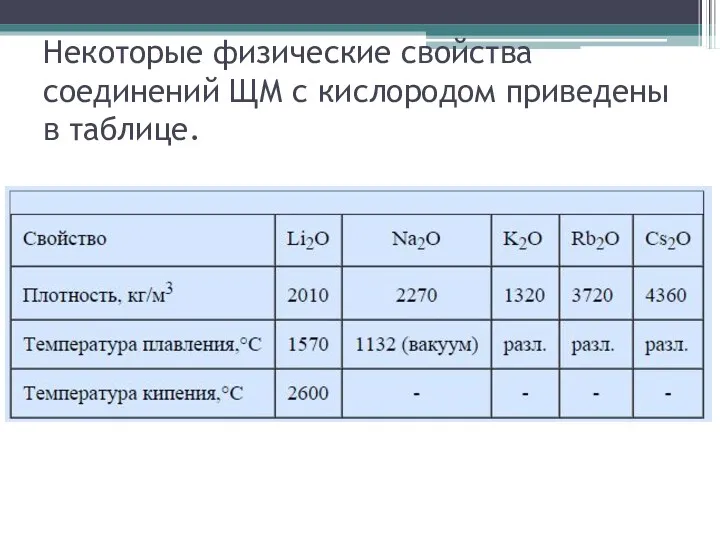
- 4. Некоторые физические свойства соединений ЩМ с кислородом приведены в таблице.
- 5. Химические свойства оксидов ЩМ: Хорошо растворяются в воде, реагируя с ней: Mе2O + H2O 2MеOH Na2O
- 6. Реагируют с кислородом, водородом, серой и хлором: 2Na2O + O2 2Na2O2 баланс Na2O + H2 NaH
- 7. Гидроксиды ЩМ (МеОН): Все гидроксиды щелочных металлов – бесцветные гигроскопичные вещества, легко расплывающиеся на воздухе, очень
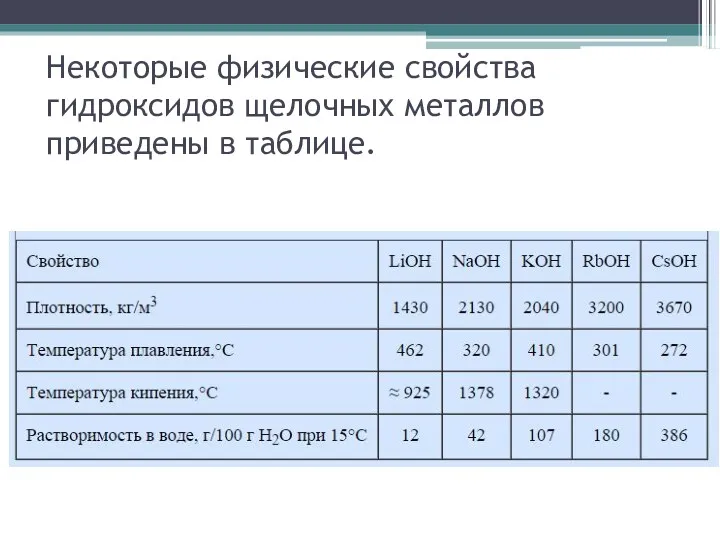
- 8. Некоторые физические свойства гидроксидов щелочных металлов приведены в таблице.
- 9. Химические свойства: Реагируют с оксидами неметаллов: 2NaOH + CO2 Na2CO3 + H2O 2KOH + 2NO2 KNO3
- 10. Взаимодействуют с амфотерными металлами и их оксидами: NaOH + Al(OH)3 NaAlO2 + 2H2O 2NaOH + Al2O3
- 11. Na2CO3 и NaHCO3 карбонат натрия гидрокарбонат натрия Карбонат натрия (Na2CO3) используется для производства бумаги, мыла и
- 12. Карбонат калия (поташ) (K2CO3) необходим при производстве жидкого мыла и стекла. Глауберова соль (Na2SO4 · 10
- 14. Скачать презентацию









 Многоатомные спирты
Многоатомные спирты Неорганические строительные материалы. Стекло
Неорганические строительные материалы. Стекло Закон сохранения массы веществ. Химические уравнения
Закон сохранения массы веществ. Химические уравнения Химический состав. Закуска
Химический состав. Закуска Chem reactions. Different Typesof Chemical Reactions
Chem reactions. Different Typesof Chemical Reactions Қанықпаған майлар және соның негізіндегі БАЗ
Қанықпаған майлар және соның негізіндегі БАЗ Мыло. Мылящие вещества в природе
Мыло. Мылящие вещества в природе Хроматография. Классификации хроматографических методов
Хроматография. Классификации хроматографических методов Органические и неорганические кислоты
Органические и неорганические кислоты Получение хлортетрациклина
Получение хлортетрациклина Индикаторы кислотно-основного титрования
Индикаторы кислотно-основного титрования Основные физико-химические свойства нефти и нефтепродуктов
Основные физико-химические свойства нефти и нефтепродуктов Каменный уголь и методы его переработки
Каменный уголь и методы его переработки Руды металлов
Руды металлов Минеральные вещества
Минеральные вещества Строение электронных оболочек атомов химических элементов 8 класс
Строение электронных оболочек атомов химических элементов 8 класс Физические свойства минералов
Физические свойства минералов Cкорость химической реакции
Cкорость химической реакции Алкины. Химические и физические свойства
Алкины. Химические и физические свойства Важнейшие минералы
Важнейшие минералы Общая характеристика халькогенов. Кислород
Общая характеристика халькогенов. Кислород Химия нефти и газа. Лекция № 1
Химия нефти и газа. Лекция № 1 Окислительно-восстановительные реакции
Окислительно-восстановительные реакции Химические аспекты метаболизма лекарственных препаратов
Химические аспекты метаболизма лекарственных препаратов Углекислый газ
Углекислый газ Качественный анализ (часть 1)
Качественный анализ (часть 1) Щелочные металлы
Щелочные металлы Предмет аналитической химии, ее структура
Предмет аналитической химии, ее структура