Содержание
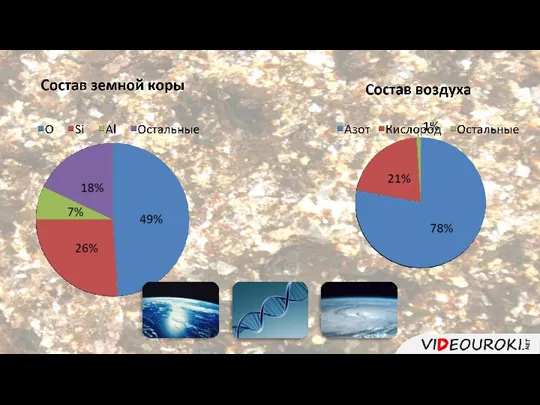
- 2. Халькогены – это элементы VIA группы. О S Se Te Po Название халькогены означает «рождающие руды».
- 3. Кислород-химический элемент Физические свойства Получение: -в лаборатории -в промышленности. 3. Химические свойства. O (оксигениум) Ar(O)=16 Кислород-простое
- 5. Получение кислорода В промышленности Из жидкого воздуха.
- 6. Дж. Пристли t В 1774 г. получил кислород. К. Шееле Получил кислород нагреванием селитры. Дал название
- 7. Получение кислорода Разложение воды Разложение перекиси водорода
- 8. Получение кислорода Разложение перекиси водорода Разложение «марганцовки»
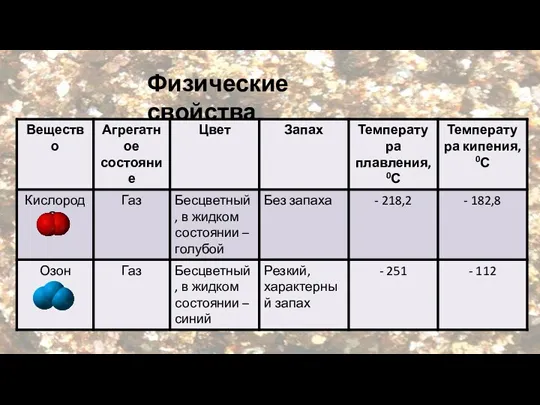
- 9. Физические свойства
- 10. Химические свойства Реакции с металлами Реакции с неметаллами 4Li + O2 = 2Li2O Оксид лития Оксид
- 11. Химические свойства Реакции со сложными веществами CH4 + 2O2 = CO2↑ + 2H2O 2H2S + 3O2
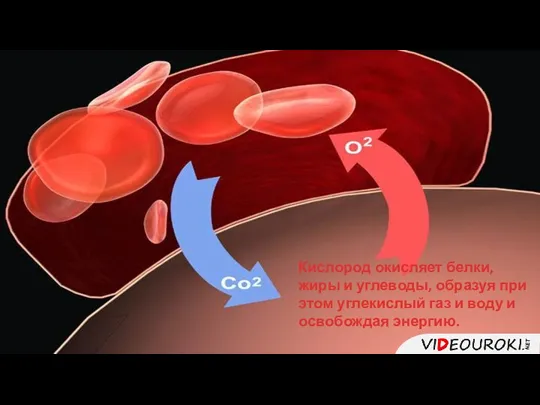
- 12. Кислород окисляет белки, жиры и углеводы, образуя при этом углекислый газ и воду и освобождая энергию.
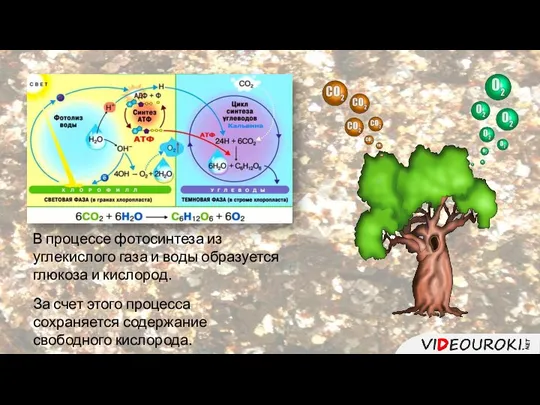
- 13. В процессе фотосинтеза из углекислого газа и воды образуется глюкоза и кислород. За счет этого процесса
- 14. Оксид марганца (IV) – катализатор.
- 15. Фермент каталаза – катализатор.
- 16. O2 1 1 – в металлургии; 2 2 – газовая сварка и резка металлов; 3 3
- 17. Хранение кислорода В промышленности В лаборатории O2 O2 O2
- 19. Скачать презентацию












 Закономерности процессов нитрования НЦ
Закономерности процессов нитрования НЦ Подготовка к ГИА. А2. Периодический закон и Периодическая система химических элементов Д.И. Менделеева
Подготовка к ГИА. А2. Периодический закон и Периодическая система химических элементов Д.И. Менделеева Решение задач. Органическая химия
Решение задач. Органическая химия Полисахариды: крахмал и целлюлоза
Полисахариды: крахмал и целлюлоза Химическая наука и промышленность в годы Великой Отечественной войны
Химическая наука и промышленность в годы Великой Отечественной войны Метал конструкциялық материалдар
Метал конструкциялық материалдар Гетероциклические соединения. Классификация, номенклатура, строение и значение гетероциклов
Гетероциклические соединения. Классификация, номенклатура, строение и значение гетероциклов Solutions and solubilities
Solutions and solubilities Геохимия изотопов стабильных элементов
Геохимия изотопов стабильных элементов p-элементы 17 группы периодической системы: галогены
p-элементы 17 группы периодической системы: галогены Супрамолекулярные системы – мост между неживой и живой материей
Супрамолекулярные системы – мост между неживой и живой материей Комплексные соединения
Комплексные соединения Углеводы (сахариды)
Углеводы (сахариды) Амфотерные соединения
Амфотерные соединения Предмет органической химии
Предмет органической химии Углеводороды (классификация и номенклатура)
Углеводороды (классификация и номенклатура) Водород. Н2
Водород. Н2 Окислительно-восстановительные реакции. 11 класс
Окислительно-восстановительные реакции. 11 класс Кислородосодержащие производные углеводородов. Спирты. Фенолы. Простые эфиры
Кислородосодержащие производные углеводородов. Спирты. Фенолы. Простые эфиры Минералы и формы существования марганца
Минералы и формы существования марганца Жидкостная хроматография
Жидкостная хроматография Поверхностные явления. Адсорбция
Поверхностные явления. Адсорбция Химия - тұрмыста
Химия - тұрмыста Строение и физические свойства металлов
Строение и физические свойства металлов Натуральный каучук
Натуральный каучук Классификация и свойства оксидов
Классификация и свойства оксидов Липиды 2. Тканевой обмен
Липиды 2. Тканевой обмен Природній та супутній нафтові гази, їх склад, використання
Природній та супутній нафтові гази, їх склад, використання