Содержание
- 2. Цель: Сформировать представление о составе, строении, номенклатуре, видах и классификации комплексных соединений. Научить давать названия комплексным
- 3. Комплексными называют соединения, содержащие сложные ионы и молекулы, способные к существованию как в кристаллическом виде, так
- 4. Швейцарский химик Альфред Вернер, лауреат Нобелевской премии. Его научная деятельность проходила в Цюрихском университете. Ученый синтезировал
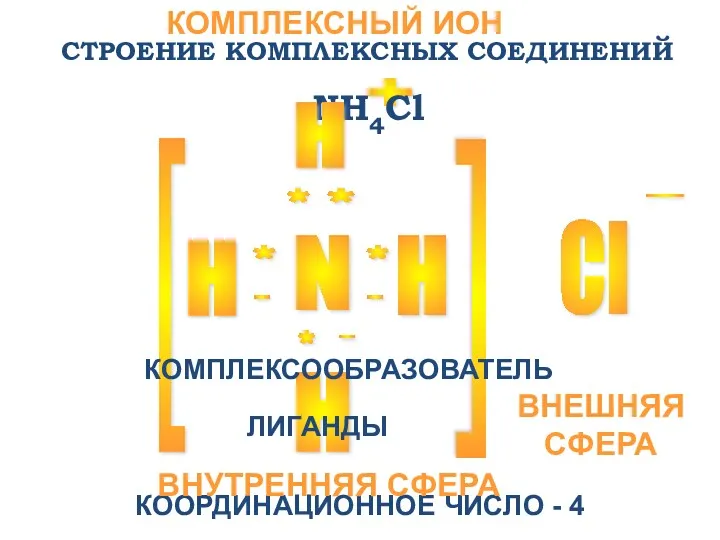
- 5. СТРОЕНИЕ КОМПЛЕКСНЫХ СОЕДИНЕНИЙ N H H H Cl + - [ [ * * * *
- 6. [N-3H+14]Cl-1 КОМПЛЕКСНЫЙ ИОН [NH4]+ ВНУТРЕННЯЯ СФЕРА: КОМПЛЕКСООБРАЗОВАТЕЛЬ N-3 ЛИГАНДЫ H+ ВНЕШНЯЯ СФЕРА АНИОН Cl-
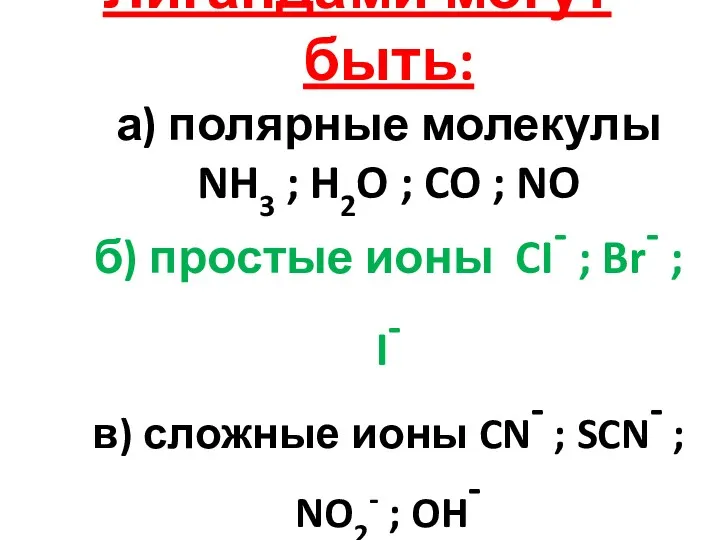
- 7. Лигандами могут быть: а) полярные молекулы NH3 ; H2O ; CO ; NO б) простые ионы
- 8. (OH)- 4 [Zn+x Na+ (+1) + x + (-1) ] 2 ·2 ·4 = 0 x
- 9. РАССТАВЬТЕ СТЕПЕНЬ ОКИСЛЕНИЯ ИОНА КОМПЛЕКСООБРАЗОВАТЕЛЯ: Na3[AlF6] Ответ: Na+3[Al+3F-6] K[MgCl3] Na[Al(OH)4] Na4[Fe(CN)6] Ответ: Na+[Al+3(OH)-4] Ответ: K+[Mg+2Cl-3] Ответ:Na+4[Fe+2(CN)-6]
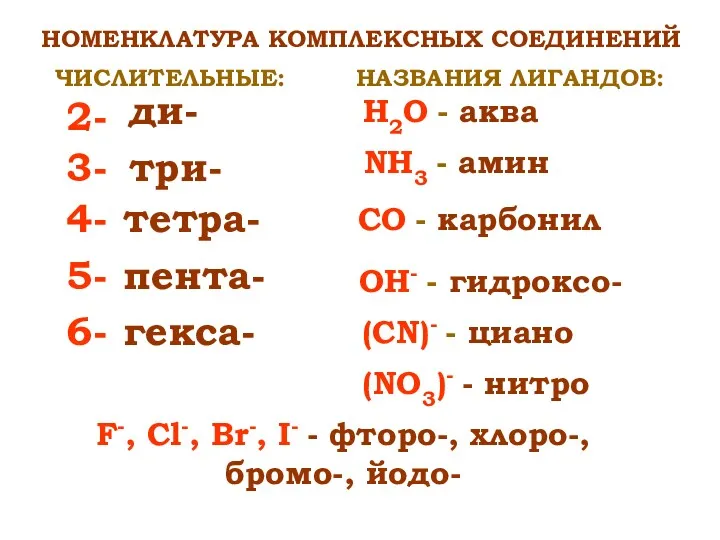
- 10. НОМЕНКЛАТУРА КОМПЛЕКСНЫХ СОЕДИНЕНИЙ 2- 4- 3- 5- 6- ди- три- тетра- пента- гекса- ЧИСЛИТЕЛЬНЫЕ: НАЗВАНИЯ ЛИГАНДОВ:
- 11. НОМЕНКЛАТУРА КОМПЛЕКСНЫХ СОЕДИНЕНИЙ НАЗВАНИЯ АНИОНОВ: Fe - феррат Cu - купрат Ag - аргентат Au -
- 12. тетра гидроксо цинкат НОМЕНКЛАТУРА КОМПЛЕКСНЫХ СОЕДИНЕНИЙ Na+2 4] (OH)- [Zn+2 натрия [Cr+3 (H2O)0 6] Cl-3 хлорид
- 13. НАЗОВИТЕ КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ Na3[AlF6] Na[Al(OH)4] K4[Fe(CN)6] Гексафтороалюминат натрия Тетрагидроксоалюминат натрия Гексационоферрат (II) калия
- 14. НАЗОВИТЕ КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ [Cu(NH3)4]SO4 Сульфат тетраамминмеди (II) [Ag(NH3)2]Cl Хлорид диамминсеребра Хлорид гексааквахрома (III) [Cr(H2O)6]Cl3
- 15. Ответ: K2[PtCl6] Гексахлороплатинат (IV) калия Гексагидроксохромат (III) натрия СОСТАВЬТЕ ФОРМУЛЫ ВЕЩЕСТВ Ответ: Na3[Cr(OH)6]
- 16. ХИМИЧЕСКИЕ СВОЙСТВА 1. Диссоциация комплексных соединений [Cu(NH3)4]SO4 ↔ [Cu(NH3)4]2+ + SO42- комплексный ион ион внешн. среды
- 18. Скачать презентацию



![[N-3H+14]Cl-1 КОМПЛЕКСНЫЙ ИОН [NH4]+ ВНУТРЕННЯЯ СФЕРА: КОМПЛЕКСООБРАЗОВАТЕЛЬ N-3 ЛИГАНДЫ H+ ВНЕШНЯЯ СФЕРА АНИОН Cl-](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/223118/slide-5.jpg)
![(OH)- 4 [Zn+x Na+ (+1) + x + (-1) ]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/223118/slide-7.jpg)
![РАССТАВЬТЕ СТЕПЕНЬ ОКИСЛЕНИЯ ИОНА КОМПЛЕКСООБРАЗОВАТЕЛЯ: Na3[AlF6] Ответ: Na+3[Al+3F-6] K[MgCl3] Na[Al(OH)4] Na4[Fe(CN)6] Ответ: Na+[Al+3(OH)-4] Ответ: K+[Mg+2Cl-3] Ответ:Na+4[Fe+2(CN)-6]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/223118/slide-8.jpg)

![тетра гидроксо цинкат НОМЕНКЛАТУРА КОМПЛЕКСНЫХ СОЕДИНЕНИЙ Na+2 4] (OH)- [Zn+2](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/223118/slide-11.jpg)
![НАЗОВИТЕ КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ Na3[AlF6] Na[Al(OH)4] K4[Fe(CN)6] Гексафтороалюминат натрия Тетрагидроксоалюминат натрия Гексационоферрат (II) калия](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/223118/slide-12.jpg)
![НАЗОВИТЕ КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ [Cu(NH3)4]SO4 Сульфат тетраамминмеди (II) [Ag(NH3)2]Cl Хлорид диамминсеребра Хлорид гексааквахрома (III) [Cr(H2O)6]Cl3](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/223118/slide-13.jpg)
![Ответ: K2[PtCl6] Гексахлороплатинат (IV) калия Гексагидроксохромат (III) натрия СОСТАВЬТЕ ФОРМУЛЫ ВЕЩЕСТВ Ответ: Na3[Cr(OH)6]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/223118/slide-14.jpg)
![ХИМИЧЕСКИЕ СВОЙСТВА 1. Диссоциация комплексных соединений [Cu(NH3)4]SO4 ↔ [Cu(NH3)4]2+ + SO42- комплексный ион ион внешн. среды](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/223118/slide-15.jpg)
 Химические формулы. Относительная молекулярная масса
Химические формулы. Относительная молекулярная масса Источники примесей в натрии быстрых реакторов. Поведение примесей в натрии. Массоперенос продуктов коррозии в натриевых контурах
Источники примесей в натрии быстрых реакторов. Поведение примесей в натрии. Массоперенос продуктов коррозии в натриевых контурах Рідкі кристали
Рідкі кристали 20230205_okislitelno-vosstanovitelnye_reaktsii
20230205_okislitelno-vosstanovitelnye_reaktsii Вуглеводні. Насичені, ненасичені та ароматичні вуглеводні: їх склад, будова, фізичні та хімічні властивості
Вуглеводні. Насичені, ненасичені та ароматичні вуглеводні: їх склад, будова, фізичні та хімічні властивості 20230306_oksidy
20230306_oksidy Спирты. Физические и химические свойства
Спирты. Физические и химические свойства Аммиак. Физические и химические свойства аммиака
Аммиак. Физические и химические свойства аммиака Зависят ли свойства предельных одноатомных спиртов от их химического строения?
Зависят ли свойства предельных одноатомных спиртов от их химического строения? Непредельные углеводороды этиленового ряда (олефины, алкены)
Непредельные углеводороды этиленового ряда (олефины, алкены) Дисперсные системы: получение и свойства
Дисперсные системы: получение и свойства Растворы. Концентрация растворов
Растворы. Концентрация растворов Соли как производные кислот и оснований
Соли как производные кислот и оснований Водород. Свойства водорода
Водород. Свойства водорода Титриметрический анализ. (Лекция 22)
Титриметрический анализ. (Лекция 22) Аммиак
Аммиак Суды тазарту әдістері
Суды тазарту әдістері Основания
Основания Сложные эфиры. Жиры. Мыла
Сложные эфиры. Жиры. Мыла Одноосновные ненасыщенные кислоты
Одноосновные ненасыщенные кислоты Периодическая таблица химических элементов
Периодическая таблица химических элементов Оксиды. Определение
Оксиды. Определение Производство чугуна и стали
Производство чугуна и стали Азот. Характеристика азота, фосфора (9класс)
Азот. Характеристика азота, фосфора (9класс) Тепловой эффект химической реакции
Тепловой эффект химической реакции Значення хімічних процесів у природі
Значення хімічних процесів у природі Алканы. Строение, номенклатура, изомерия, химические и физические свойства
Алканы. Строение, номенклатура, изомерия, химические и физические свойства Механохимиялық активтеу әдісі
Механохимиялық активтеу әдісі