Содержание
- 2. План изучения темы: Состав, названия и определение оснований. Классификация оснований. Физические свойства оснований. Химические свойства оснований.
- 3. Основания – это сложные вещества, состоящие из атома металла и одной или нескольких гидроксогрупп.
- 4. Состав оснований: Назовите составные части оснований. Ме(ОН)х СО гидроксогруппы (ОН) – 1 Количество гидроксогрупп определяется СО
- 5. Найдите формулы оснований и назовите их 1 вариант 2 вариант
- 6. Выберите формулы оснований. Назовите их. НСl, NaOH, Na2O, Ca(OH)2, H2SO4, P2O5, Fe(OH)3, MgO, Cи(OH)2
- 7. Основания NaOH – гидроксид натрия Ca(OH)2 – гидроксид кальция Fe(OH)3 – гидроксид железа (III) Cи(OH)2 –
- 8. Классификация
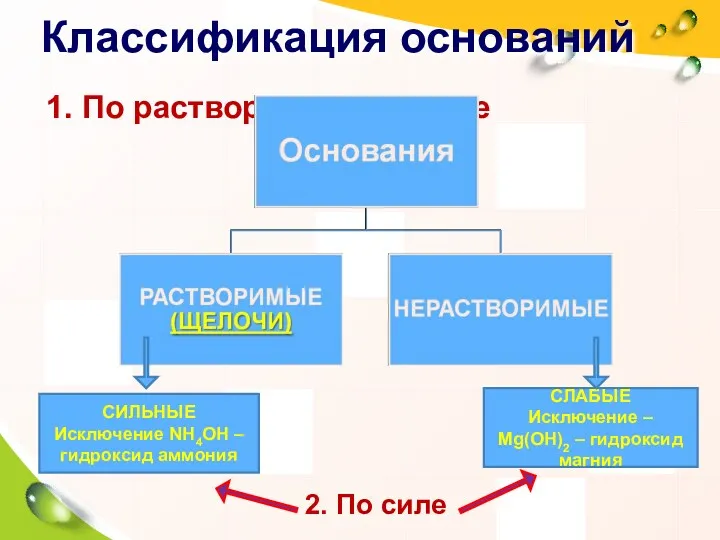
- 9. Классификация оснований 1. По растворимости в воде СЛАБЫЕ Исключение – Mg(OH)2 – гидроксид магния СИЛЬНЫЕ Исключение
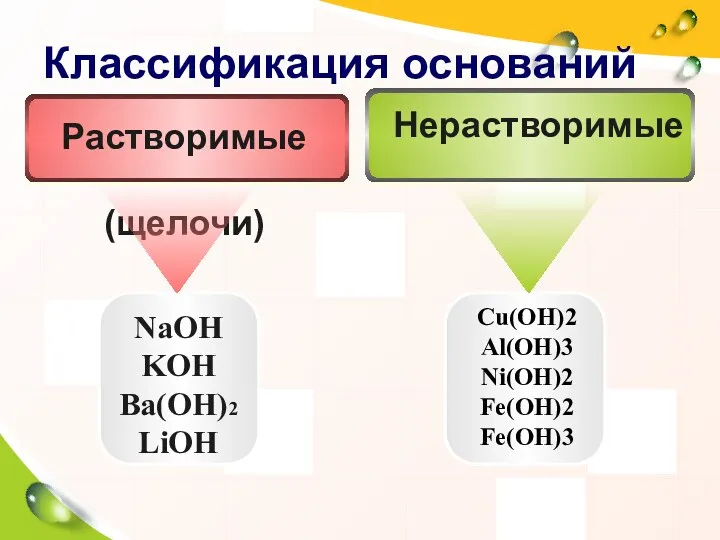
- 10. Классификация оснований NaOH KOH Ba(OH)2 LiOH Cu(OH)2 Al(OH)3 Ni(OH)2 Fe(OH)2 Fe(OH)3 Нерастворимые Растворимые (щелочи)
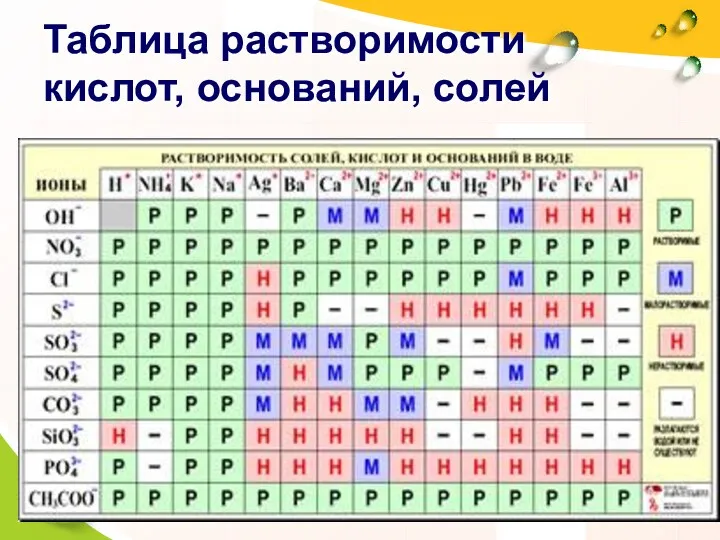
- 11. Таблица растворимости кислот, оснований, солей
- 12. По какому признаку основания разделены на группы? NaOH KOH LiOH СsOH Cu(OH)2 Ba(OH)2 Pb(OH)2 Fe(OH)2 Al(OH)3
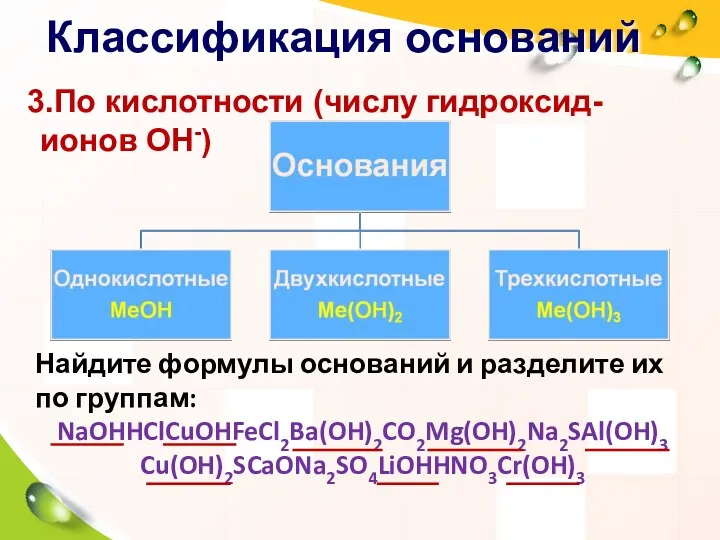
- 13. Классификация оснований 3.По кислотности (числу гидроксид-ионов ОН-) Найдите формулы оснований и разделите их по группам: NaOHHClCuOHFeCl2Ba(OH)2CO2Mg(OH)2Na2SAl(OH)3
- 14. Однокислотные NaOH, KOH Двухкислотные Pb(OH)2, Fe(OH)2 Трехкислотные Al(OH)3 Классификация оснований по числу гидроксогрупп. Основания
- 15. Физические свойства
- 16. Физические свойства оснований Агрегатное состояние: Все твердые вещества Цвет : Белого – КОН, Голубого - Cu(OH)2
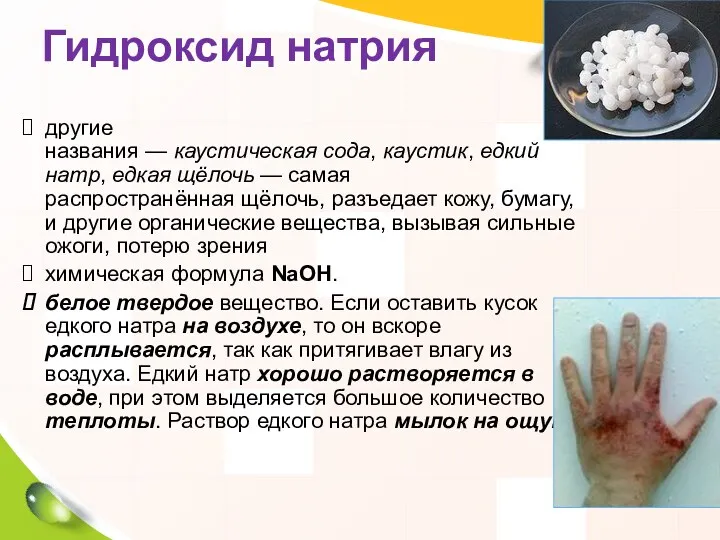
- 17. Гидроксид натрия другие названия — каустическая сода, каустик, едкий натр, едкая щёлочь — самая распространённая щёлочь,
- 18. Едкий натр применяется во множестве отраслей промышленности и для бытовых нужд: в целлюлозно-бумажной промышленности в производстве
- 19. Химические свойства
- 20. Химические свойства нерастворимых оснований. 1). Разлагаются при нагревании. 2). Взаимодействуют с кислотами (реакция нейтрализации).
- 21. Химические свойства щелочей. 1). Изменяют окраску индикаторов. Взаимодействуют с: 2). кислотами (реакция нейтрализации), 3). кислотными оксидами,
- 23. ПРАВИЛА БЕЗОПАСНОСТИ Едкое вещество—щелочь! Разрушает и раздражает кожу, слизистые оболочки. Попавшие на кожу капли раствора щелочи
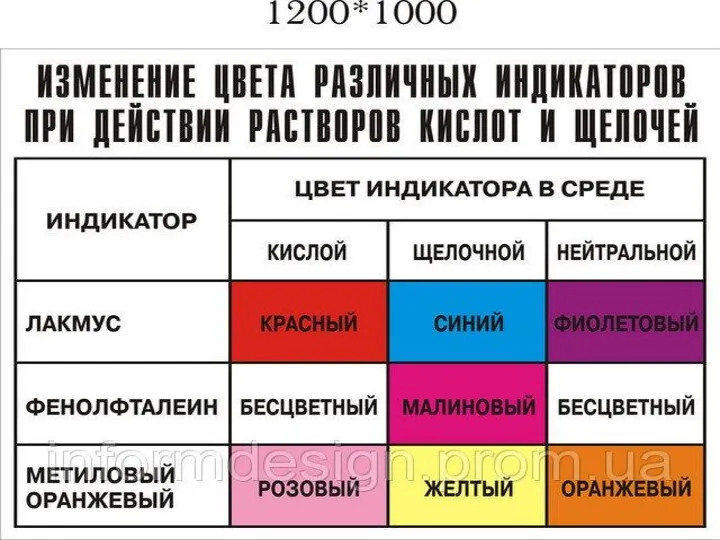
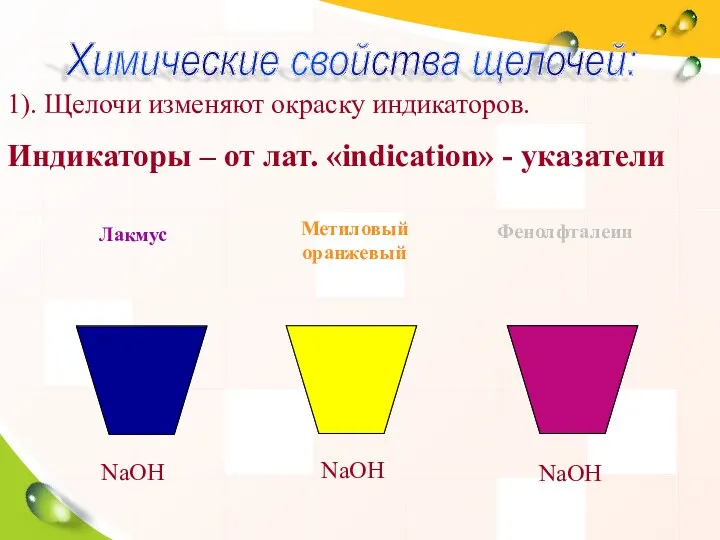
- 24. 1). Щелочи изменяют окраску индикаторов. Индикаторы – от лат. «indication» - указатели NaOH NaOH NaOH Лакмус
- 25. Щелочь + кислота : Ва(ОН)2 + 2НСl = ВаСl2 + 2Н2О хлорид бария Химические свойства щелочей:
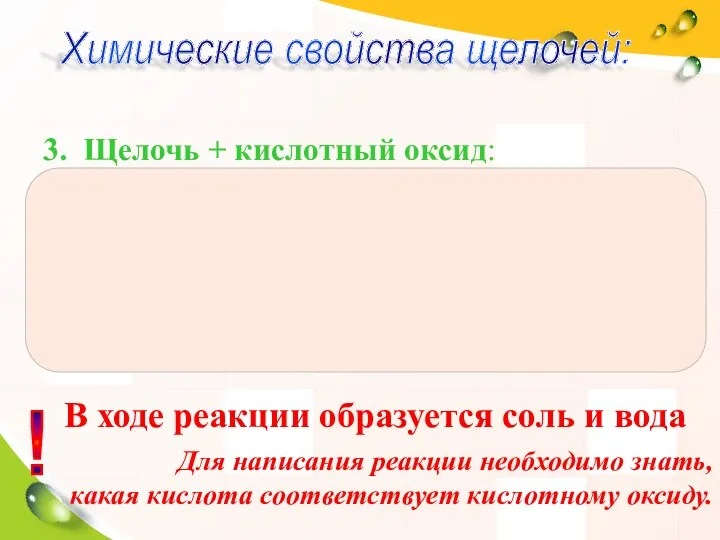
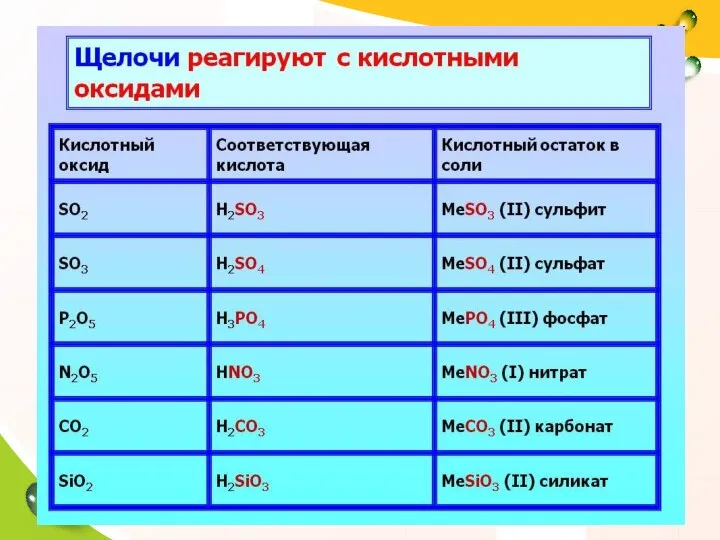
- 26. 3. Щелочь + кислотный оксид: Химические свойства щелочей: ! В ходе реакции образуется соль и вода
- 28. 4. Щелочь + соль = Химические свойства щелочей: Условия протекания реакции: 1). исходные вещества должны быть
- 29. Д/З § 31, выполнить задания со слайдов
- 31. Скачать презентацию



















 Химическое равновесие. Принцип Ле Шателье
Химическое равновесие. Принцип Ле Шателье Соединения галогенов
Соединения галогенов Аминокислоты. Пептиды. Хроматографические методы исследования
Аминокислоты. Пептиды. Хроматографические методы исследования Химическая связь
Химическая связь Массовая доля вещества в растворе
Массовая доля вещества в растворе Визначення іонів лужних і лужноземельних іонів у природних водах
Визначення іонів лужних і лужноземельних іонів у природних водах Уникальная соль (для дошколников)
Уникальная соль (для дошколников) Пищевые добавки
Пищевые добавки Коллигативные свойства растворов
Коллигативные свойства растворов Основы термической и химико-термической обработки стали. Теория и технология термической обработки стали. Лекция 3. Тема 7
Основы термической и химико-термической обработки стали. Теория и технология термической обработки стали. Лекция 3. Тема 7 Литий. Физические свойства лития
Литий. Физические свойства лития Типы заданий. ЕГЭ №32
Типы заданий. ЕГЭ №32 20230419_izomery
20230419_izomery Растворы и растворители
Растворы и растворители Фосфор и его соединения
Фосфор и его соединения Общая характеристика неметаллов
Общая характеристика неметаллов Простые вещества. Игра Счастливый случай
Простые вещества. Игра Счастливый случай Элемент, имеющий относительную атомную массу
Элемент, имеющий относительную атомную массу Введение в аналитическую химию. Введение в качественный анализ
Введение в аналитическую химию. Введение в качественный анализ Алканы. Гомологи
Алканы. Гомологи Методы разделения и исследования состава нефти и газа
Методы разделения и исследования состава нефти и газа Формальная кинетика. Предмет химической кинетики
Формальная кинетика. Предмет химической кинетики Хром. Элемент под № 24
Хром. Элемент под № 24 Аммиак. Состав вещества
Аммиак. Состав вещества Галогены. Фтор, хлор, бром, йод, астат
Галогены. Фтор, хлор, бром, йод, астат Породообразующие минералы
Породообразующие минералы Особенности строения, реакционной способности и методы синтеза гидроксилсодержащих соединений
Особенности строения, реакционной способности и методы синтеза гидроксилсодержащих соединений Взрывоопасные грузы
Взрывоопасные грузы