Содержание
- 2. Коллигативные свойства - это свойства растворов, которые не зависят от природы растворенного вещества, его массы, размеров,
- 3. Коллигативные свойства (продолжение) Для разбавленных растворов (а значит, по своему состоянию близких к идеальным) такими свойствами
- 4. Изучение коллигативных свойств разбавленных растворов служит одним из наиболее распространенных способов определения М(Х), степени диссоциации α,
- 5. План лекции Осмос и осмотическое давление Закон Вант Гоффа Значение осмоса в биологии и медицине Гемолиз
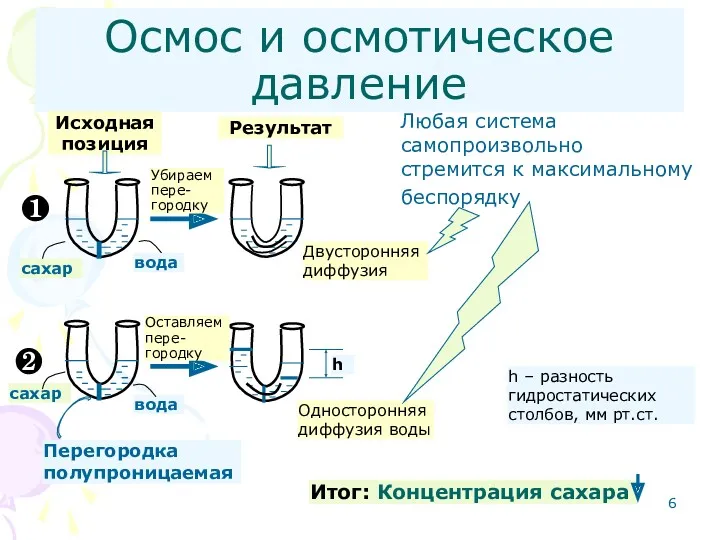
- 6. Осмос и осмотическое давление ❶ ❷ Исходная позиция Убираем пере- городку Оставляем пере- городку Перегородка полупроницаемая
- 7. Осмос и осмотическое давление (продолжение) Односторонняя диффузия растворителя из раствора с меньшей концентрацией в раствор с
- 8. Осмос и осмотическое давление (продолжение) Односторонняя диффузия растворителя через полупроницаемую перегородку (осмос) будет происходить до тех
- 9. От чего зависит осмотическое давление? В. Пфеффер (1877) установил, что Росм зависит прямо пропорционально от концентрации
- 10. Закон Вант-Гоффа (1887) Осмотическое давление раствора равно тому давлению, которое производило бы растворенное вещество, если бы
- 11. Закон Вант-Гоффа (продолжение) Росм идеального раствора можно вычислить по уравнению Менделеева-Клайперона: PV = nRT где Р
- 12. или Росм = = CMRT Осмотическое давление р-ров неэлектролитов прямо пропорционально молярной концентрации раствора. Растворы, имеющие
- 13. Осмотическое давление растворов электролитов Электролиты в растворе распадаются на ионы, и концентрация кинетических («дочерних») частиц становится
- 14. Изотонический коэффициент i показывает, во сколько раз осмотическое давление электролитов больше осмотического давления неэлектролитов при одинаковой
- 15. Роль осмоса в биологических процессах Осмос вместе с диализом является одной из причин поступления воды и
- 16. Роль осмоса в биологических процессах (продолжение) Осмос лежит в основе целого ряда физиологических процессов, протекающих в
- 17. Плазмолиз Если растительная (или животная) клетка попадает в среду раствора с повышенной концентрацией солей и других
- 18. Росм (крови человека) = const и достигает 740 – 780 кПа или 7,4 – 7,8 атм
- 19. Осмолярная концентрация растворенных в крови в-в Сом = = = 0,287 моль/л В медицинской и фармацевтической
- 20. Физиологические растворы это изотоничные крови растворы: 0,85 % NaCl 4,5 – 5 % раствор глюкозы Нефизиологические
- 21. Плазмолиз эритроцитов Если вводимый в вену р-р гипертоничен, то будет происходить осмос воды из эритроцитов в
- 22. Гемолиз эритроцитов Если вводимый в вену р-р гипотоничен по отношению к плазме, то осмос воды будет
- 23. Гемолиз эритроцитов (продолжение) Начальная стадия гемолиза наступает уже при снижении осмотического давления плазмы до 360 –
- 25. Скачать презентацию





















 Строение атома. Лекция 2
Строение атома. Лекция 2 Гетерофункциональные соединения
Гетерофункциональные соединения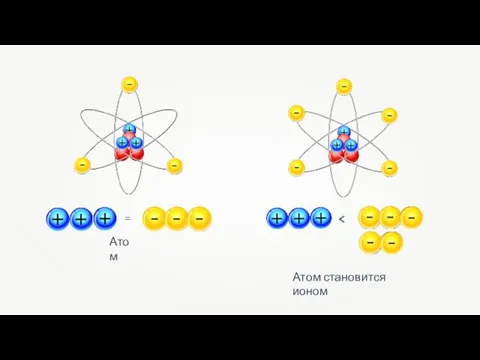 Ионная связь
Ионная связь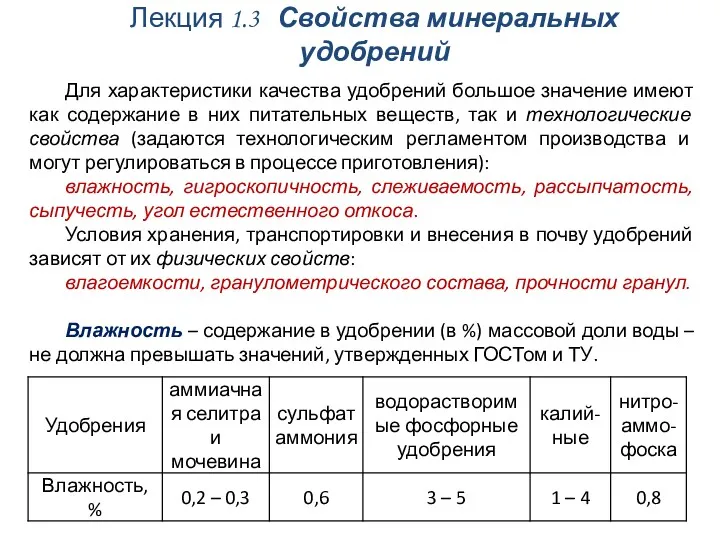 Свойства минеральных удобрений
Свойства минеральных удобрений Химическая кинетика
Химическая кинетика Подготовка к ГИА. А2. Периодический закон и Периодическая система химических элементов Д.И. Менделеева
Подготовка к ГИА. А2. Периодический закон и Периодическая система химических элементов Д.И. Менделеева Основные постулаты квантовой механики
Основные постулаты квантовой механики Гидролиз солей
Гидролиз солей Physical chemistry of nanostructured systems
Physical chemistry of nanostructured systems Природный газ и нефть
Природный газ и нефть Соединения железа
Соединения железа Периодический закон и периодическая система Д.И. Менделеева. 9 класс
Периодический закон и периодическая система Д.И. Менделеева. 9 класс Совместимость электродных материалов в новой электрохимической системе Li4Ti5O12/Li3V2(PO4)3 с традиционным электролитом для
Совместимость электродных материалов в новой электрохимической системе Li4Ti5O12/Li3V2(PO4)3 с традиционным электролитом для Предельные углеводороды. (9 класс)
Предельные углеводороды. (9 класс) Типы химических реакций
Типы химических реакций Амины. Анилин
Амины. Анилин Оксид кремния
Оксид кремния Окислительно – восстановительные реакции
Окислительно – восстановительные реакции Третья группа, главная подгруппа. 9 класс
Третья группа, главная подгруппа. 9 класс Азотная кислота
Азотная кислота Виды присадок к моторным топливам. Присадки к дизельному топливу
Виды присадок к моторным топливам. Присадки к дизельному топливу Физические и химические явления
Физические и химические явления Классификация химических реакций
Классификация химических реакций Полисахариды. Крахмал и целлюлоза
Полисахариды. Крахмал и целлюлоза Жескость воды
Жескость воды Защитно-декоративные покрытия
Защитно-декоративные покрытия Чистые вещества и смеси. Растворы
Чистые вещества и смеси. Растворы Химический элемент V группы: сурьма
Химический элемент V группы: сурьма