Содержание
- 2. ЗАКРЕПЛЕНИЕ ИЗУЧЕННОГО МАТЕРИАЛА Выполним задание « Найди родственников» Из перечня формул составьте генетический ряд.(вопросы…) Ca(OH)2, CI2,
- 3. Общий вывод: Признаки которые характеризуют генетический ряд: Вещества разных классов; Разные вещества образованные одним химическим элементом,
- 4. Вспомним … 1.Валентность. 2.Степень окисления. 3.Восстановитель. 4.Окислитель. 5.Типы химических реакций.
- 5. Окислительно –восстановительные Реакции
- 6. Цель урока: 1.Сформировать понятие об окислительно-восстановительных реакциях. 2.Научиться уравнивать записи ОВР методом электронного баланса.
- 7. Пример: 2Cu0 + O2 =2 Cu2+O2- 2H+CL- + Zn0 = Zn2+CL2- + H20 Реакции, в резултате
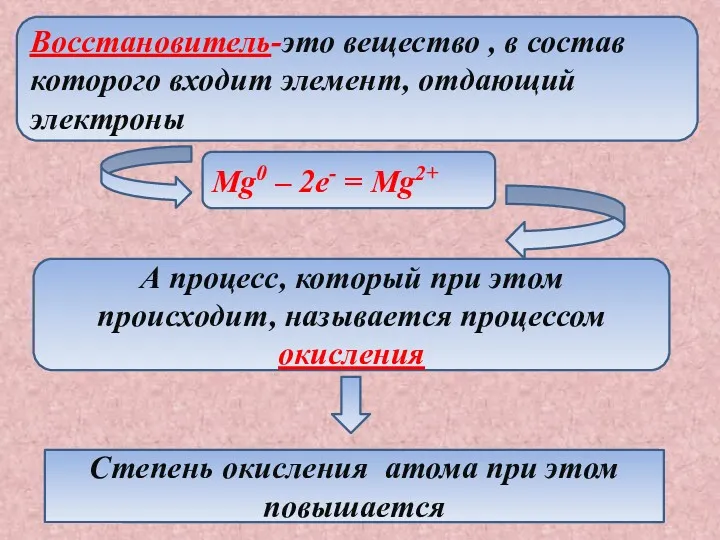
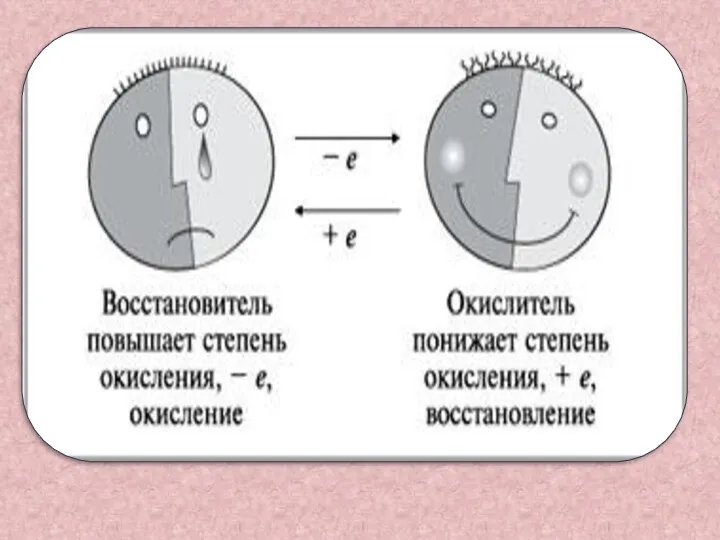
- 8. Восстановитель-это вещество , в состав которого входит элемент, отдающий электроны Mg0 – 2e- = Mg2+ А
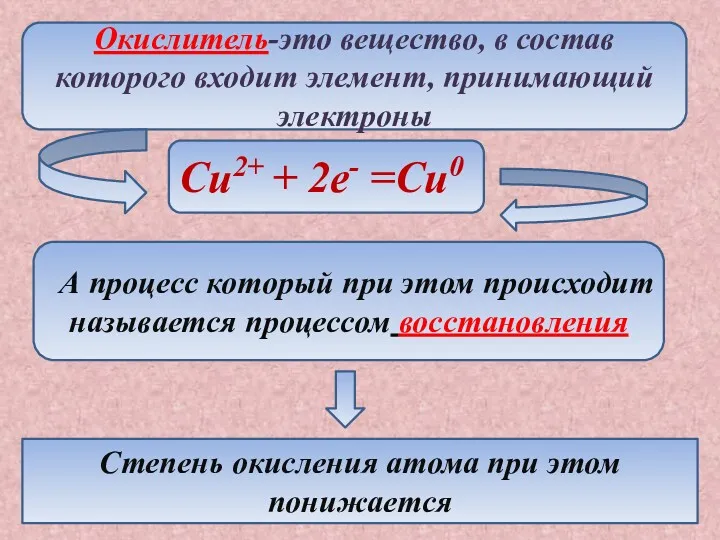
- 9. Окислитель-это вещество, в состав которого входит элемент, принимающий электроны Cu2+ + 2e- =Cu0 А процесс который
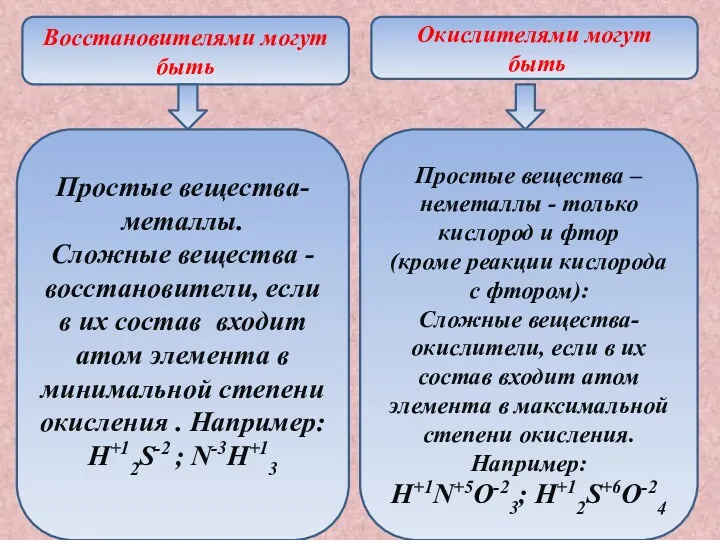
- 11. Восстановителями могут быть Окислителями могут быть Простые вещества-металлы. Сложные вещества - восстановители, если в их состав
- 12. Различают: минимальную (низшую) степень окисления S-2 2e- 8e- 8e- промежуточную степень окисления S0 2e- 8e- 6e-
- 13. План составления окислительно -восстановительной реакции Записываем схему химической реакции Ca + O2 2. Расставляем степени окисления
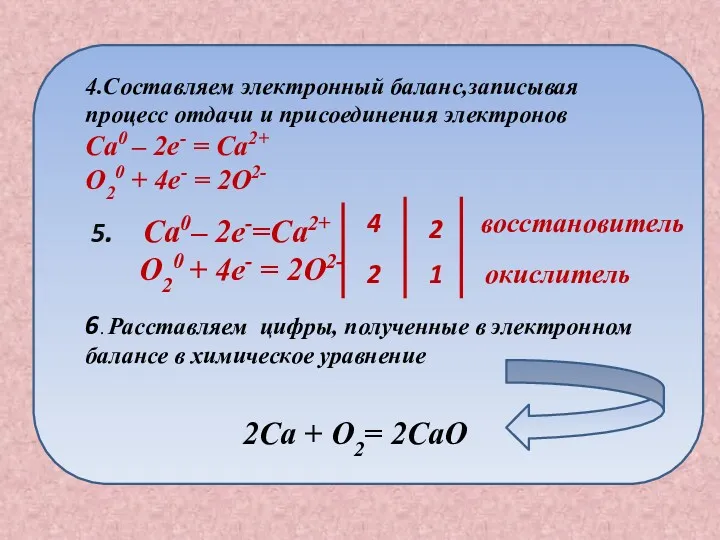
- 14. 5. Ca0– 2e-=Ca2+ O20 + 4e- = 2O2- 4 2 2 1 восстановитель окислитель 6. Расставляем
- 16. Скачать презентацию








 Галогены. Хлор
Галогены. Хлор Кристаллография и основы кристаллохимии. Закон постоянства углов. Методы проецирования кристаллов. Лекция №6
Кристаллография и основы кристаллохимии. Закон постоянства углов. Методы проецирования кристаллов. Лекция №6 Геохимические барьеры
Геохимические барьеры Периодическая таблица Д.И. Менделеева. Своя игра
Периодическая таблица Д.И. Менделеева. Своя игра Высокомолекулярные соединения
Высокомолекулярные соединения Гидрогеохимия урана и тория
Гидрогеохимия урана и тория Основы органической химии. Углеводороды. Алкины
Основы органической химии. Углеводороды. Алкины Серная кислота и её свойства
Серная кислота и её свойства Кремний и его соединения
Кремний и его соединения Введение в коллоидную химию. Основные понятия и закономерности
Введение в коллоидную химию. Основные понятия и закономерности Аминокислоты. Пептиды. Белки
Аминокислоты. Пептиды. Белки Химические свойства предельных одноатомных спиртов
Химические свойства предельных одноатомных спиртов Валентность и степень окисления
Валентность и степень окисления Общая характеристика неметаллов
Общая характеристика неметаллов 20230419_kontsentratsiya
20230419_kontsentratsiya Физико-химические свойства белков. Электрофоретические и хроматографические методы
Физико-химические свойства белков. Электрофоретические и хроматографические методы Водородная связь (11 класс)
Водородная связь (11 класс) Химическое равновесие
Химическое равновесие Проект узла регенерации растворителя уксусной кислоты производства терефталевой кислоты
Проект узла регенерации растворителя уксусной кислоты производства терефталевой кислоты Адсорбция. Физическая и химическая адсорбция
Адсорбция. Физическая и химическая адсорбция Аминокислоты. Изомерия. Белки
Аминокислоты. Изомерия. Белки Химический состав клетки. Неорганические вещества клетки
Химический состав клетки. Неорганические вещества клетки Катализ металлами. Лекция 3
Катализ металлами. Лекция 3 Емтихан сұрақтары
Емтихан сұрақтары Химическая промышленность и химическая технология
Химическая промышленность и химическая технология Обмен липидов
Обмен липидов Химический элемент цинк
Химический элемент цинк Анионактивті беттік активті заттар
Анионактивті беттік активті заттар