Содержание
- 2. Определение и этимология галогенов Галоге́ны (от греч. ἁλός — «соль» и γένος — «рождение, происхождение»;) —
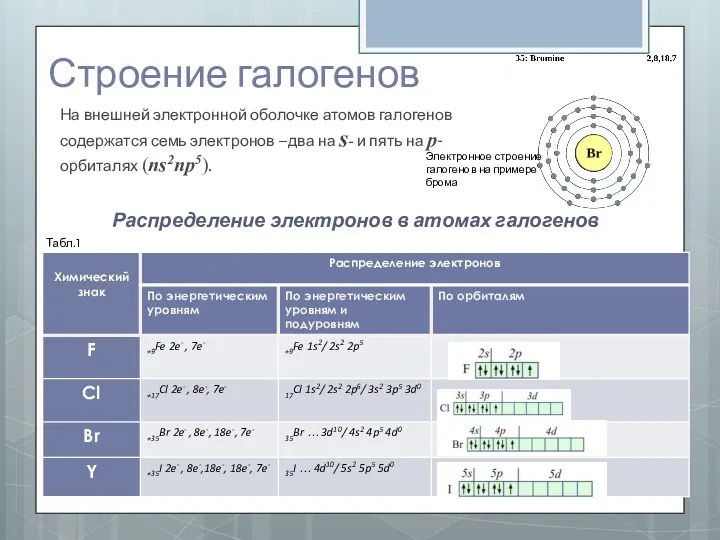
- 3. Строение галогенов На внешней электронной оболочке атомов галогенов содержатся семь электронов –два на s- и пять
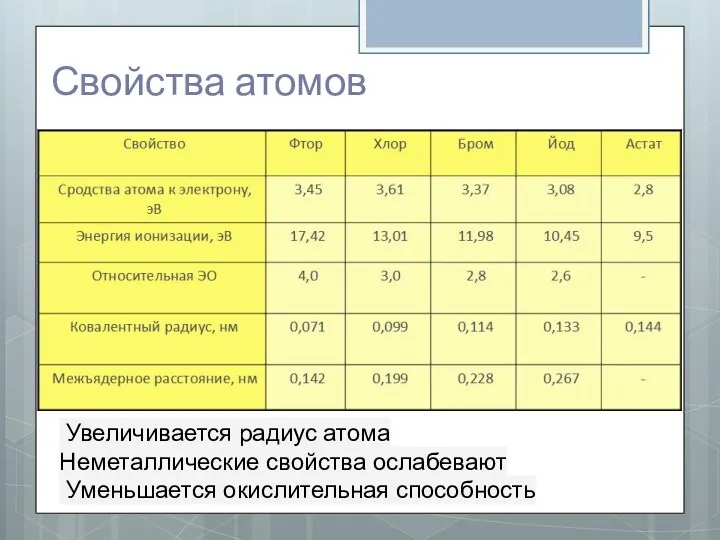
- 4. Свойства атомов Увеличивается радиус атома Неметаллические свойства ослабевают Уменьшается окислительная способность
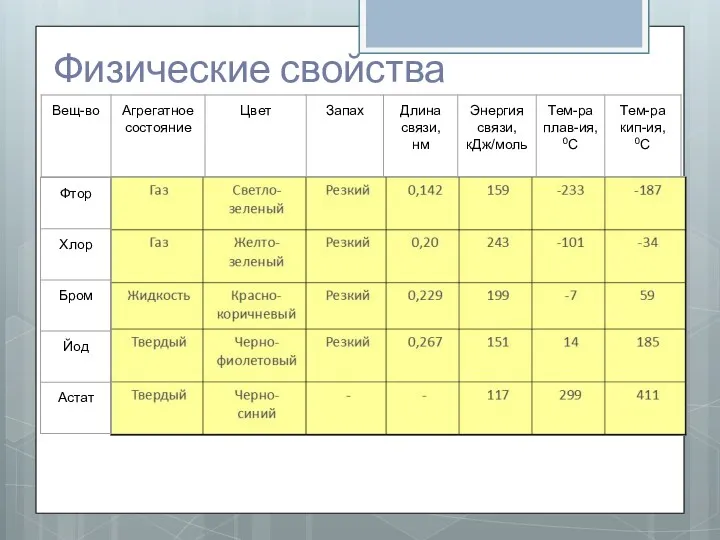
- 5. Физические свойства
- 6. Вывод С увеличением относительной молекулярной массы веществ увеличивается температура кипения и температура плавления. Все простые вещества
- 7. Получение галогенов В свободном состоянии галогены в природе не встречаются. Обычно они встречаются в восстановленном состоянии,
- 8. Химические свойства Все галогены проявляют высокую окислительную активность, которая уменьшается при переходе от фтора к астату,
- 9. Окислительно-восстановительные свойства Об уменьшении окислительных и увеличении восстановительных свойств галогенов от фтора к иоду можно судить
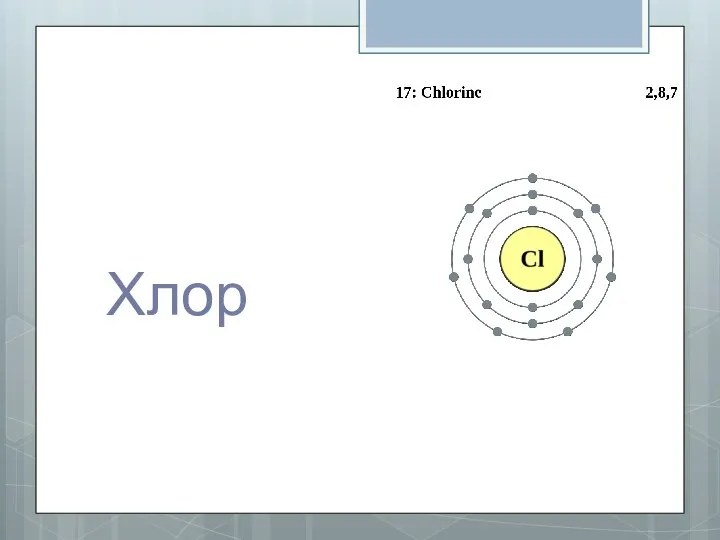
- 10. Хлор
- 11. Минералы Карналлит Каменная соль = поваренная соль = галит Сильвин
- 12. Получение Основной промышленный способ получения хлора – электролиз хлоридов щелочных металлов (NaCl, KCl). Также его получают
- 13. Химические свойства Хлор – активный окислитель. Энергично реагирует с металлами и большинством неметаллов (за исключением O2,
- 14. Хлор - один из самых активных неметаллов. При взаимодействии с металлами с переменной валентностью (Fe, Cr)
- 15. С неМеталлами H2 + Cl2 = 2 HCl(на свету) 2Cl2 + C = CCl4 3Cl2 +
- 16. С бескислородным кислотами Cl2 + HBr = 2HCl + Br2 Cl2 + HI = 2HCl +
- 17. Хлор в органике Хлор является активным реагентом в органическом синтезе. Его атомы входят в состав молекул
- 18. Применение хлора Хлор применяют во многих отраслях промышленности, науки и бытовых нужд: Основным компонентом отбеливателей является
- 19. Для обеззараживания воды — «хлорирования». В химическом производстве соляной кислоты, хлорной извести, бертолетовой соли, хлоридов металлов,
- 20. Опыт 1. Демонстрирует способы получения хлора и его физические свойства. а) Взаимодействие соляной кислоты с оксидом
- 21. б)Взаимодействие концентрированной соляной кислоты с перманганатом калия и получение хлорной воды. Колбу Вюрца закрепляем в штативе,
- 22. Опыт 2. Демонстрирует химические свойства хлора при взаимодействии с простыми веществами. а) Горение водорода в хлоре.
- 23. б) Взрыв смеси хлора с водородом. Один стеклянный цилиндр наполнить водородом, а другую – хлором. Закрыть
- 25. Скачать презентацию


















 р-элементы V группы (пниктогены) N, P, As, Sb, Bi
р-элементы V группы (пниктогены) N, P, As, Sb, Bi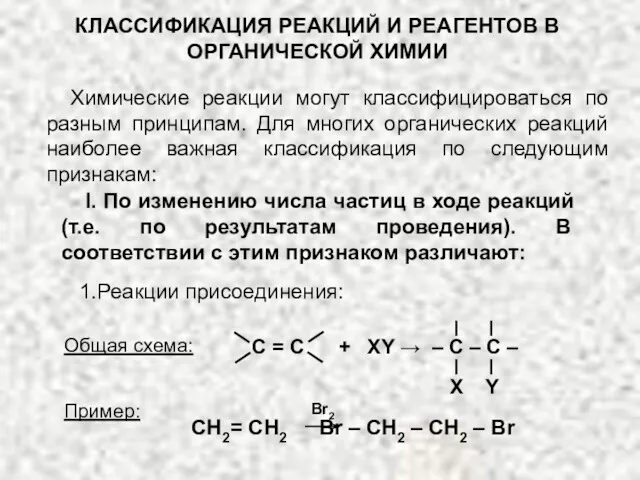 Классификация реакций и реагентов органической химии
Классификация реакций и реагентов органической химии Цинк. Нахождение в природе
Цинк. Нахождение в природе Урок-аукцион Фосфор и его свойства.
Урок-аукцион Фосфор и его свойства. 20231110_zakon_avogadro
20231110_zakon_avogadro Бытовая химия в нашем доме и альтернативные способы уборки
Бытовая химия в нашем доме и альтернативные способы уборки Растворы. (Лекция 7)
Растворы. (Лекция 7) Сполуки неметалічних елементів з гідрогеном. Амоніак та хлороводень
Сполуки неметалічних елементів з гідрогеном. Амоніак та хлороводень Презентации-задания к урокам химии по различным темам
Презентации-задания к урокам химии по различным темам Природные источники углеводородов
Природные источники углеводородов Вычисление массы растворённого вещества, содержащегося в определённой массе раствора с известной массовой долей
Вычисление массы растворённого вещества, содержащегося в определённой массе раствора с известной массовой долей Оксид углерода-С
Оксид углерода-С Своя игра по химии
Своя игра по химии Небезпечні хімічні речовини
Небезпечні хімічні речовини Проблемный химический эксперимент как составная часть проблемного обучения химии
Проблемный химический эксперимент как составная часть проблемного обучения химии Строение и свойства металлов Физические и механические свойства металлов
Строение и свойства металлов Физические и механические свойства металлов Окисно-відновні реакції. Процеси окиснення, відновлення, окисник та відновник
Окисно-відновні реакції. Процеси окиснення, відновлення, окисник та відновник Фосфор и его соединения
Фосфор и его соединения Полифункциональды (гетерофункциональды) биоорганикалық қосылыстар: оксиқышқылдар, альдегидо- және кетоқышқылдар
Полифункциональды (гетерофункциональды) биоорганикалық қосылыстар: оксиқышқылдар, альдегидо- және кетоқышқылдар Роль химии в создании новых материалов
Роль химии в создании новых материалов Циклоалканы. Строение циклоалканов
Циклоалканы. Строение циклоалканов Периодическая система Д.И. Менделеева
Периодическая система Д.И. Менделеева Соединения химических элементов. 8 класс
Соединения химических элементов. 8 класс Введение в химическую технологию топлив и углеродных материалов
Введение в химическую технологию топлив и углеродных материалов Аппаратчик химводоочистки. Билеты для экзамена с ответами (1-16)
Аппаратчик химводоочистки. Билеты для экзамена с ответами (1-16) Распределение лучистой энергии в спектре солнечной радиации до поступления в атмосферу и в спектре абсолютно черного тела
Распределение лучистой энергии в спектре солнечной радиации до поступления в атмосферу и в спектре абсолютно черного тела Номенклатура органических веществ
Номенклатура органических веществ Изотопный обмен
Изотопный обмен