Содержание
- 2. КЛАССИФИКАЦИЯ РЕАКЦИЙ И РЕАГЕНТОВ В ОРГАНИЧЕСКОЙ ХИМИИ R – X + Y → R – Y
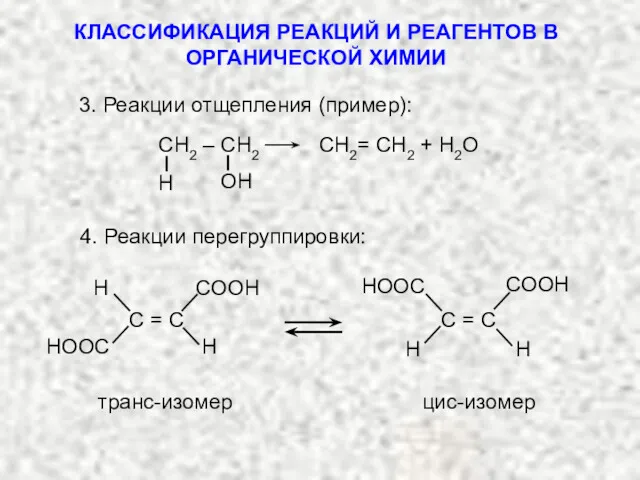
- 3. СН2 – СН2 СН2= СН2 + H2O 4. Реакции перегруппировки: транс-изомер цис-изомер 3. Реакции отщепления (пример):
- 4. Реакции замещения характерны для всех классов органических соединений. Реакции присоединения характерны только для соединений с кратной
- 5. ТИПЫ РЕАГЕНТОВ: 1. Электрофильные (Е+). 2. Нуклеофильные (Nu-). 3. Радикальные (R∙). КЛАССИФИКАЦИЯ РЕАКЦИЙ II. по электронной
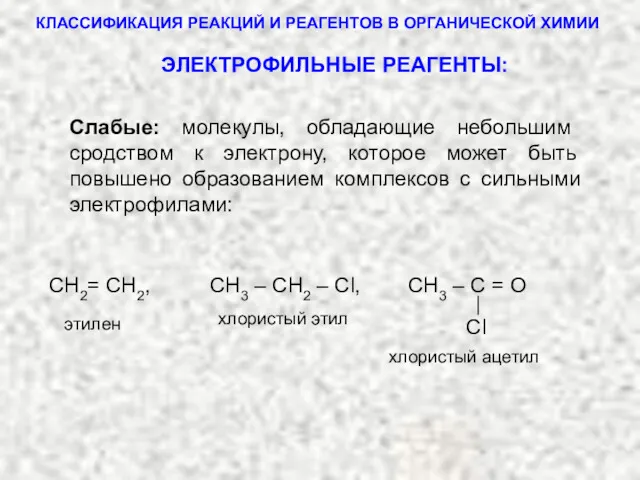
- 6. 1. ЭЛЕКТРОФИЛЬНЫЕ РЕАГЕНТЫ (электрофилы) Электрофилы можно подразделить на сильные и слабые: Электрофилы – это частицы, обладающие
- 7. ТИПЫ РЕАГЕНТОВ Сильные: H+, Me+, HgCl+, FeCl2+, AlCl3 , FeBr3, SbCl5, BF3, ZnCl2 и другие частицы,
- 8. КЛАССИФИКАЦИЯ РЕАКЦИЙ И РЕАГЕНТОВ В ОРГАНИЧЕСКОЙ ХИМИИ Сl СН2= СН2, СН3 – СН2 – Cl, СН3
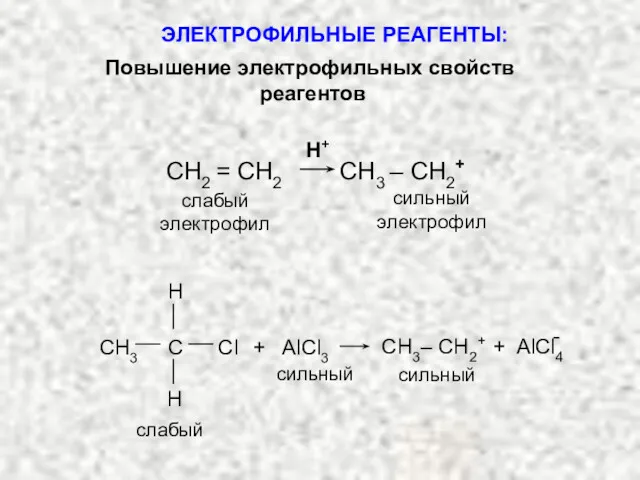
- 9. СН2 = СН2 СН3 – СН2+ Н+ - слабый электрофил С H H CН3 Cl +
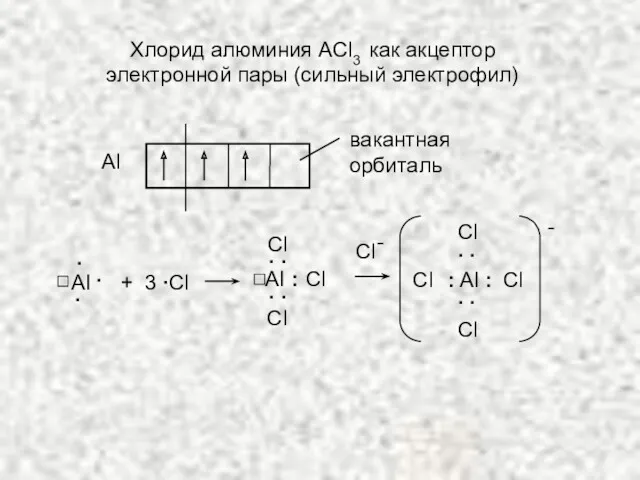
- 10. Аl вакантная орбиталь AI . . . + 3 ∙Сl Сl AI : . . .
- 11. КЛАССИФИКАЦИЯ РЕАКЦИЙ И РЕАГЕНТОВ В ОРГАНИЧЕСКОЙ ХИМИИ Сильные нуклеофилы: к ним относятся: ОН− , анионы с
- 12. К ним относятся анионы, являющиеся остатками сильных кислот: Сl− , Br−, HSO3−, NO3−, CNS−, H2PO42− и
- 13. Классификация реакций и реагентов в органической химии Как видно из рассмотренных примеров, нуклеофилы в то же
- 14. Нуклеофильность зависит от электронной плотности на атакуемом атоме. Нуклеофильность – это функция зависящая от основности и
- 15. 2. Если нуклеофильные центры разные, то в этом случае нуклеофильность будет функцией поляризуемости, например, в ряду:
- 16. ПРОМЕЖУТОЧНЫЕ ПРОДУКТЫ РЕАКЦИЙ (ИНТЕРМЕДИАТЫ) Ионы – частицы, несущие электрический заряд; их два сорта: Карбкатионы – органические
- 17. КЛАССИФИКАЦИЯ РЕАКЦИЙ И РЕАГЕНТОВ В ОРГАНИЧЕСКОЙ ХИМИИ МЕТОДЫ ГЕНЕРИРОВАНИЯ (ОБРАЗОВАНИЯ) ИОНОВ И РАДИКАЛОВ: (X = F,
- 18. III. КЛАССИФИКАЦИЯ РЕАКЦИЙ ПО МЕХАНИЗМУ ЭЛЕМЕНТАРНЫХ СТАДИЙ Это наиболее сложный тип, классифицирующий реакции. Он соответствует двум
- 19. Гомологический (радикальный) разрыв ковалентной связи: А : В А• + •В радикалы Из схемы видно, что
- 20. КЛАССИФИКАЦИЯ РЕАКЦИЙ И РЕАГЕНТОВ В ОРГАНИЧЕСКОЙ ХИМИИ Реагенты, в органической химии, вступающие в реакцию, подразделяют на
- 21. КЛАССИФИКАЦИЯ РЕАКЦИЙ И РЕАГЕНТОВ В ОРГАНИЧЕСКОЙ ХИМИИ IV. Классификация реакций по частным признакам. Реакции называют в
- 22. ПО МЕХАНИЗМУ РЕАКЦИЙ. Под механизмом реакций понимают реальный путь, то которому протекает реакция. Реакция может протекать
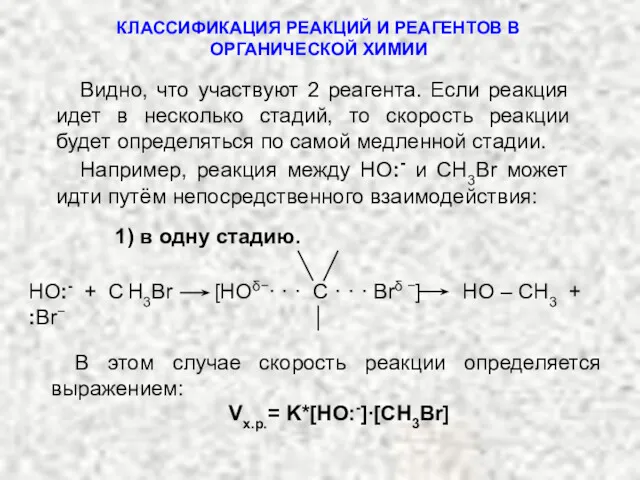
- 23. Видно, что участвуют 2 реагента. Если реакция идет в несколько стадий, то скорость реакции будет определяться
- 24. 2) Или в две стадии. В этом случае скорость реакции будет задаваться выражением: Vх.р.= K∙[ СН3Br]
- 25. КЛАССИФИКАЦИЯ РЕАКЦИЙ И РЕАГЕНТОВ В ОРГАНИЧЕСКОЙ ХИМИИ End
- 27. Скачать презентацию



















 Углекислый газ СО2
Углекислый газ СО2 Методы хроматографии. Ионообменная хроматография
Методы хроматографии. Ионообменная хроматография Спирти
Спирти Енергетичний стан поверхні. Сорбційні явища. Мезопористі матеріали
Енергетичний стан поверхні. Сорбційні явища. Мезопористі матеріали Основи, їх склад, назви, класифікація
Основи, їх склад, назви, класифікація Зависят ли свойства предельных одноатомных спиртов от их химического строения?
Зависят ли свойства предельных одноатомных спиртов от их химического строения? Фосфор
Фосфор Кислород O2
Кислород O2 Жесткость воды
Жесткость воды Азотная кислота
Азотная кислота Всероссийская олимпиада школьников по химии (региональный этап). Разбор заданий, 9 класс
Всероссийская олимпиада школьников по химии (региональный этап). Разбор заданий, 9 класс Непредельные углеводороды: этилен
Непредельные углеводороды: этилен Поверхностно-активные вещества (ПАВ). Классификация ПАВ по степени влияния на окружающую среду
Поверхностно-активные вещества (ПАВ). Классификация ПАВ по степени влияния на окружающую среду Гниение. Брожение
Гниение. Брожение Теория кристаллического поля
Теория кристаллического поля Вещества и их свойства
Вещества и их свойства Азотные удобрения
Азотные удобрения Непредельные углеводороды
Непредельные углеводороды Теория электрической диссоциации
Теория электрической диссоциации Бор шикізатын қышқылдық ыдырату
Бор шикізатын қышқылдық ыдырату Органолептические и визуальные методы идентификация полимера
Органолептические и визуальные методы идентификация полимера Аминокислоты. Физические свойства
Аминокислоты. Физические свойства Введение в химическую технологию топлив и углеродных материалов
Введение в химическую технологию топлив и углеродных материалов Основания. Неорганические соединения
Основания. Неорганические соединения Положение в периодической системе Менделеева водорода, лантаноидов, актиноидов и искусственно полученных элементов
Положение в периодической системе Менделеева водорода, лантаноидов, актиноидов и искусственно полученных элементов Формы минералов и их агрегатов
Формы минералов и их агрегатов Основи. Властивості, застосування гідроксидів Натрію і Калію
Основи. Властивості, застосування гідроксидів Натрію і Калію