Содержание
- 2. Что это такое? Аминокислоты (аминокарбоновые кислоты; АМК) — органические соединения, в молекуле которых одновременно содержатся карбоксильные
- 4. Аминокислоты классифицируют по структурным признакам. 1. В зависимости от взаимного расположения амино- и карбоксильной групп аминокислоты
- 5. Физические свойства По физическим свойствам аминокислоты резко отличаются от соответствующих кислот и оснований. Все они кристаллические
- 6. Общие химические свойства Все аминокислоты — амфотерные соединения, они могут проявлять как кислотные свойства, обусловленные наличием
- 7. Общие химические свойства (продолжение). II. Свойства карбоксильной группы (кислотность) 1. С основаниями → образуются соли: NH2-CH2-COOH
- 8. Общие химические свойства (продолжение). III. Свойства аминогруппы (основность) 1. С сильными кислотами → соли: HOOC-CH2-NH2 +
- 9. Получение Аминокислот. 3. Микробиологический синтез. Известны микроорганизмы, которые в процессе жизнедеятельности продуцируют α - аминокислоты белков.
- 11. Скачать презентацию
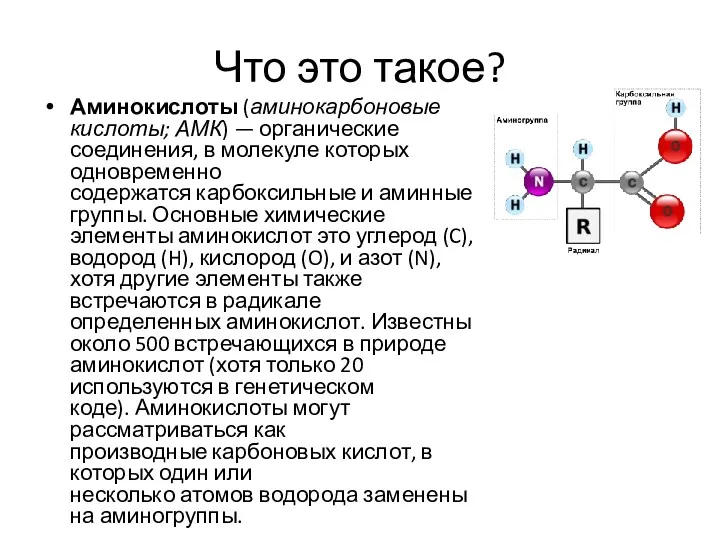
Что это такое?
Аминокислоты (аминокарбоновые кислоты; АМК) — органические соединения, в молекуле которых одновременно содержатся карбоксильные и аминные группы.
Что это такое?
Аминокислоты (аминокарбоновые кислоты; АМК) — органические соединения, в молекуле которых одновременно содержатся карбоксильные и аминные группы.
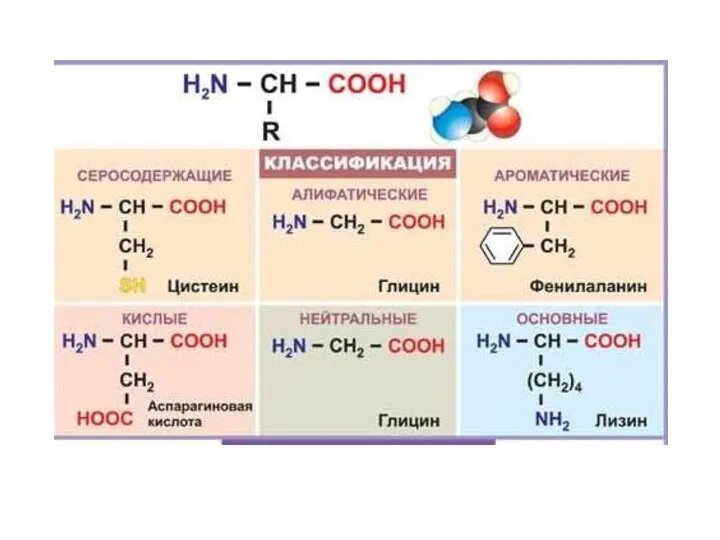
Аминокислоты классифицируют по структурным признакам.
1. В зависимости от взаимного расположения амино- и
Аминокислоты классифицируют по структурным признакам.
1. В зависимости от взаимного расположения амино- и
2. В зависимости от количества функциональных групп различают кислые, нейтральные и основные.
3. По характеру углеводородного радикала различают алифатические (жирные), ароматические, серосодержащие и гетероциклические аминокислоты. Приведенные выше аминокислоты относятся к жирному ряду.
Физические свойства
По физическим свойствам аминокислоты резко отличаются от соответствующих кислот и оснований. Все
Физические свойства
По физическим свойствам аминокислоты резко отличаются от соответствующих кислот и оснований. Все
Общие химические свойства
Все аминокислоты — амфотерные соединения, они могут проявлять как кислотные свойства, обусловленные наличием в
Общие химические свойства
Все аминокислоты — амфотерные соединения, они могут проявлять как кислотные свойства, обусловленные наличием в
NH2 —CH2 —COOH + HCl → HCl • NH2 —CH2 —COOH (хлороводородная соль глицина)NH2 —CH2 —COOH + NaOH → H2O + NH2 —CH2 —COONa (натриевая соль глицина)
Растворы аминокислот в воде благодаря этому обладают свойствами буферных растворов, то есть находятся в состоянии внутренних солей
NH2 —CH2COOH N+H3 —CH2COO-Аминокислоты обычно могут вступать во все реакции, характерные для карбоновых кислот и аминов.
Этерификация:
NH2 —CH2 —COOH + CH3OH → H2O + NH2 —CH2 —COOCH3 (метиловый эфир глицина)Важной особенностью аминокислот является их способность к поликонденсации, приводящей к образованию полиамидов, в том числе пептидов, белков, нейлона, капрона.
Реакция образования пептидов:
HOOC —CH2 —NH —H + HOOC —CH2 —NH2 → HOOC —CH2 —NH —CO —CH2 —NH2 + H2OИзоэлектрической точкой аминокислоты называют значение pH, при котором максимальная доля молекул аминокислоты обладает нулевым зарядом. При таком pH аминокислота наименее подвижна в электрическом поле, и данное свойство можно использовать для разделения аминокислот, а также белков и пептидов.
Цвиттер-ионом называют молекулу аминокислоты, в которой аминогруппа представлена в виде -NH3+, а карбоксигруппа — в виде -COO−. Такая молекула обладает значительным дипольным моментом при нулевом суммарном заряде. Именно из таких молекул построены кристаллы большинства аминокислот.
Некоторые аминокислоты имеют несколько аминогрупп и карбоксильных групп. Для этих аминокислот трудно говорить о каком-то конкретном цвиттер-ионе.
Общие химические свойства (продолжение).
II. Свойства карбоксильной группы (кислотность)
1. С основаниями → образуются
Общие химические свойства (продолжение).
II. Свойства карбоксильной группы (кислотность)
1. С основаниями → образуются
NH2-CH2-COOH + NaOH → NH2-CH2-COONa + H2O
NH2-CH2-COONa - натриевая соль 2-аминоуксусной кислоты
2. Со спиртами → образуются сложные эфиры – летучие вещества (р. этерификации): NH2-CH2-COOH + CH3OH HCl(газ)→ NH2-CH2-COOCH3 + H2O
NH2-CH2-COOCH3 - метиловый эфир 2- аминоуксусной кислоты
3. С аммиаком → образуются амиды:
NH2-CH(R)-COOH + H-NH2 → NH2-CH(R)-CONH2 + H2O
4. Практическое значение имеет внутримолекулярное взаимодействие функциональных групп ε-аминокапроновой кислоты, в результате которого образуется ε-капролактам (полупродукт для получения капрона):
Общие химические свойства (продолжение).
III. Свойства аминогруппы (основность)
1. С сильными кислотами →
Общие химические свойства (продолжение).
III. Свойства аминогруппы (основность)
1. С сильными кислотами →
HOOC-CH2-NH2 + HCl → [HOOC-CH2-NH3]Cl
или HOOC-CH2-NH2*HCl
2. С азотистой кислотой (подобно первичным аминам):
NH2-CH(R)-COOH + HNO2 → HO-CH(R)-COOH + N2↑+ H2O
гидроксокислота
Измерение объёма выделившегося азота позволяет определить количество аминокислоты (метод Ван-Слайка)
IV. Качественная реакция
1. Все аминокислоты окисляются нингидрином с образованием продуктов сине-фиолетового цвета!
2. С ионами тяжелых металлов α-аминокислоты образуют внутрикомплексные соли. Комплексы меди (II), имеющие глубокую синюю окраску, используются для обнаружения α-аминокислот.
Получение Аминокислот.
3. Микробиологический синтез. Известны микроорганизмы, которые в процессе жизнедеятельности продуцируют α
Получение Аминокислот.
3. Микробиологический синтез. Известны микроорганизмы, которые в процессе жизнедеятельности продуцируют α






 Металлы и сплавы с высокой удельной прочностью
Металлы и сплавы с высокой удельной прочностью Химическая термодинамика
Химическая термодинамика Комплексообразователь. (Лекция 5)
Комплексообразователь. (Лекция 5) Классификация органических веществ
Классификация органических веществ Сравнительная характеристика галогенов
Сравнительная характеристика галогенов Амин қышқылдар
Амин қышқылдар Металлы и сплавы, их строение. Классификация и маркировка сталей. Влияние химических элементов на свариваемость
Металлы и сплавы, их строение. Классификация и маркировка сталей. Влияние химических элементов на свариваемость Фенол и его свойства. (10 класс)
Фенол и его свойства. (10 класс) Строение атома
Строение атома Липиды. Классификация липидов
Липиды. Классификация липидов Крахмал. Строение вещества
Крахмал. Строение вещества Значення хімії у житті людини
Значення хімії у житті людини Определение нефтепродуктов в воде с использованием Флюората-02-5М
Определение нефтепродуктов в воде с использованием Флюората-02-5М Каменный уголь
Каменный уголь Экспертные системы распознавания химических веществ
Экспертные системы распознавания химических веществ Бензо́л (C6H6, PhH)
Бензо́л (C6H6, PhH) Поняття про валентність. Ребус
Поняття про валентність. Ребус Текстовые задачи на проценты, смеси и сплавы
Текстовые задачи на проценты, смеси и сплавы Строение и свойства металлов. Физические и механические свойства металлов
Строение и свойства металлов. Физические и механические свойства металлов Игровая программа по химии Самый умный. Химические свойства оксидов, оснований, кислот и солей
Игровая программа по химии Самый умный. Химические свойства оксидов, оснований, кислот и солей Природные источники углеводородов
Природные источники углеводородов Покрытия: виды, принципы создания, свойства, применение. Получение покрытий золь-гель методом. Супергидрофобные покрытия
Покрытия: виды, принципы создания, свойства, применение. Получение покрытий золь-гель методом. Супергидрофобные покрытия Органическая химия
Органическая химия 21. Кислоты. Определение кислот
21. Кислоты. Определение кислот Бериллий, магний и щелочноземельные металлы
Бериллий, магний и щелочноземельные металлы Общая характеристика неметаллов
Общая характеристика неметаллов Сера. Аллотропия серы. Физические и химические свойства серы. Применение серы
Сера. Аллотропия серы. Физические и химические свойства серы. Применение серы Р-элементы VI A группы. Свойства их соединений
Р-элементы VI A группы. Свойства их соединений