Содержание
- 2. Уровни изучения объектов в химии Субмолекулярный – атом Молекулярный – молекула Надмолекулярный - вещество
- 3. Планетарная модель атома
- 4. Современные представления об атоме Атом – электроотрицательная частица, состоящая из положительно заряженного ядра и отрицательно заряженной
- 5. Состав атома и его свойства Протон – элементарная частица в составе ядра атома. Имеет положительный электрический
- 6. Массовое число атома. Физический смысл порядкового номера в пс.
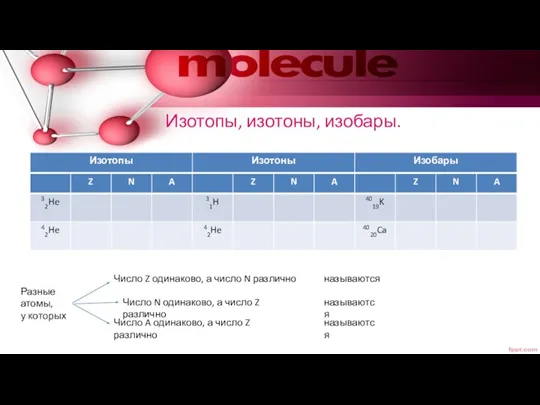
- 7. Изотопы, изотоны, изобары. Разные атомы, у которых Число Z одинаково, а число N различно Число N
- 8. Основное состояние атома. Строение электронной оболочки. Электронная орбиталь – пространство вокруг ядра, в котором наиболее вероятно
- 9. Энергетические уровни. Главное квантовое число Электронная оболочка атома состоит из
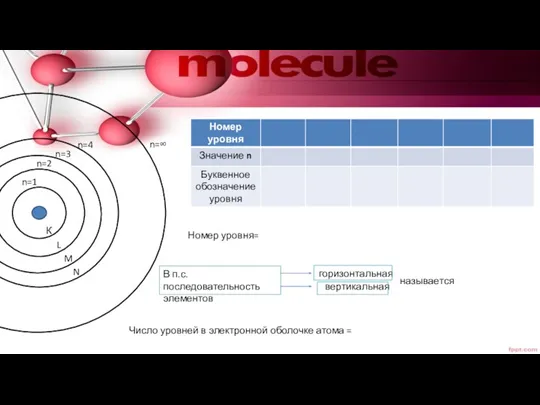
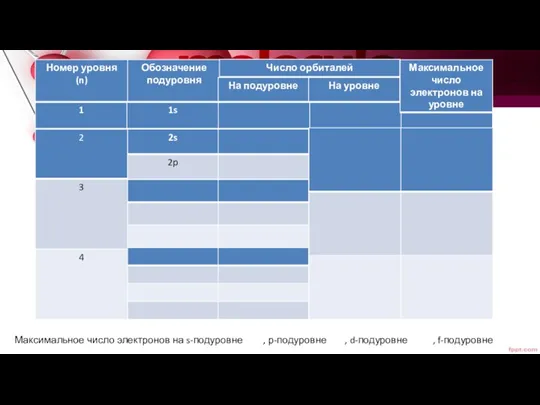
- 10. К L M N n=1 n=2 n=3 n=4 n=∞ Номер уровня= В п.с. последовательность элементов горизонтальная
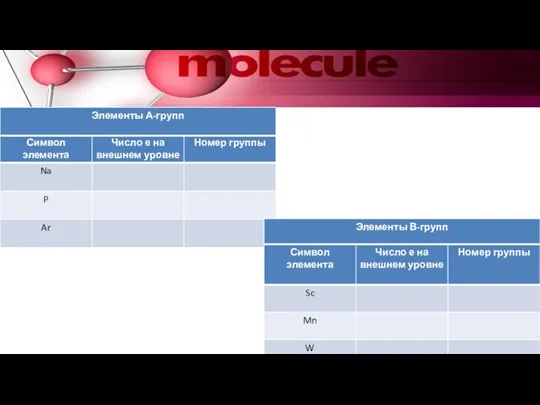
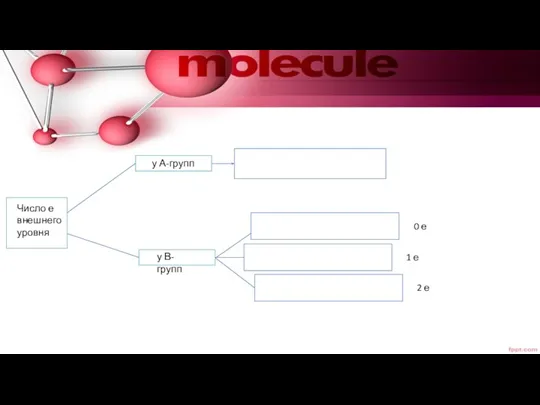
- 12. Число е внешнего уровня у А-групп у В-групп 0 е 1 е 2 е
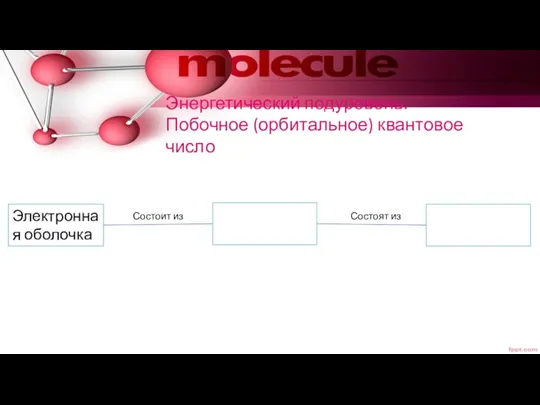
- 13. Энергетический подуровень. Побочное (орбитальное) квантовое число Электронная оболочка Состоит из Состоят из
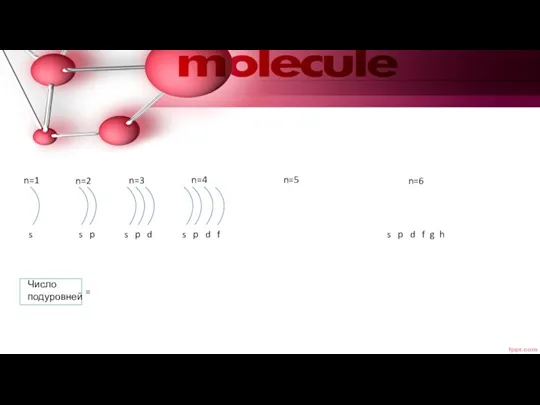
- 14. n=1 n=2 n=3 n=4 n=5 n=6 s s p s p d s p d f
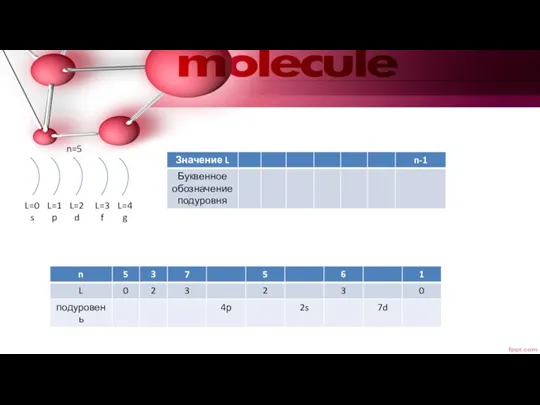
- 15. L=0 s L=1 p L=2 d L=3 f L=4 g n=5
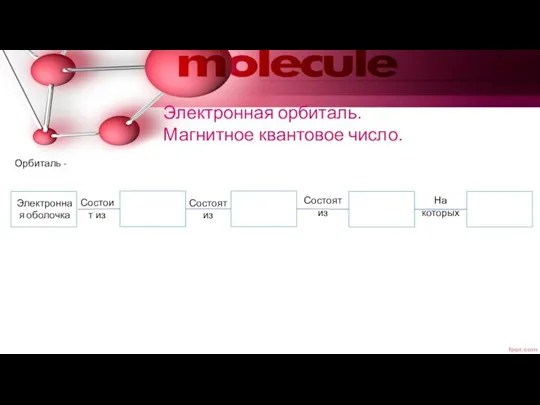
- 16. Электронная орбиталь. Магнитное квантовое число. Орбиталь - Электронная оболочка Состоит из Состоят из Состоят из На
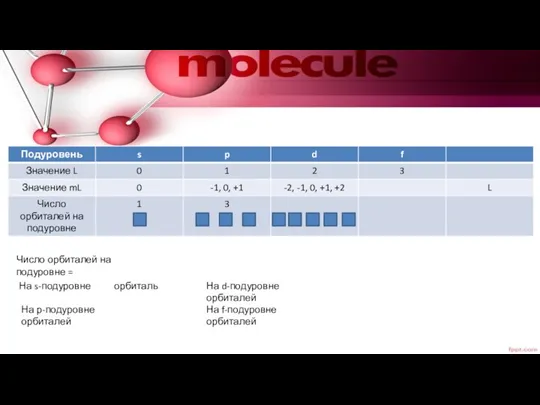
- 17. Число орбиталей на подуровне = На s-подуровне орбиталь На р-подуровне орбиталей На d-подуровне орбиталей На f-подуровне
- 19. Свойства электрона. Свойства электронной орбитали n=1 n=2 n=3 Значение главного квантового числа n определяет орбитали, который
- 20. x x x x y y y y z z z z ∞ ∞ ∞ Значение
- 21. Спиновое квантовое число. Правило Хунда Принцип Паули – Максимальное число электронов на орбитали =
- 22. Орбитали Вакантные Полузаселенные Полностью заселенные Спаренные е – е, которые находяться на одной орбитали Правило Хунда
- 23. Максимальное число электронов на s-подуровне , р-подуровне , d-подуровне , f-подуровне
- 24. Как зависит число орбиталей на уровне от значения главного квантового числа n Как зависит максимальное число
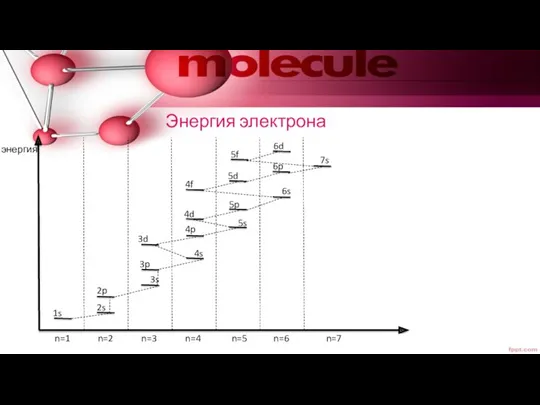
- 25. Энергия электрона энергия n=1 n=2 n=3 n=4 n=5 n=6 n=7 1s 2s 3s 4s 5s 6s
- 26. Энергия электрона растет А) с ростом Б) при равенстве с ростом
- 28. Скачать презентацию














 Углеводы. Моносахариды
Углеводы. Моносахариды Растворы. Общие свойства растворов
Растворы. Общие свойства растворов Бораты и силикаты как матрицы лазеров. Свойства и методы выращивания
Бораты и силикаты как матрицы лазеров. Свойства и методы выращивания Непредельные углеводороды. Алкены
Непредельные углеводороды. Алкены Электрохимическая коррозия металлов
Электрохимическая коррозия металлов Полезные геологические химические соединения. Получение меди из малахита
Полезные геологические химические соединения. Получение меди из малахита Химическая связь
Химическая связь Автомобильные эксплуатационные материалы и экономия топливно-энергетических ресурсов. Автомобильные бензины
Автомобильные эксплуатационные материалы и экономия топливно-энергетических ресурсов. Автомобильные бензины Общие проблемы определения низких концентраций
Общие проблемы определения низких концентраций Составление формул химических соединений
Составление формул химических соединений Water and its properties
Water and its properties Волокна. Классификация волокон
Волокна. Классификация волокон Эмпирические законы кристаллографии
Эмпирические законы кристаллографии Периодический закон Д.И. Менделеева
Периодический закон Д.И. Менделеева Аномальные свойства воды – основа жизни на Земле
Аномальные свойства воды – основа жизни на Земле Силикатная промышленность. 9 класс
Силикатная промышленность. 9 класс Карбоновые кислоты (часть 1)
Карбоновые кислоты (часть 1) Визитка химического элемента. Водород
Визитка химического элемента. Водород Виділення з суміші речовин. Прості речовини
Виділення з суміші речовин. Прості речовини Органические соединения серы
Органические соединения серы Основные классы химических соединений
Основные классы химических соединений Електроліз. Найпоширеніші способи застосування
Електроліз. Найпоширеніші способи застосування Топливный элемент
Топливный элемент Закон минимума Либиха. Ограничивающий фактор
Закон минимума Либиха. Ограничивающий фактор Добування кисню
Добування кисню Периодический закон и периодическая система химических элементов Д.И. Менделеева
Периодический закон и периодическая система химических элементов Д.И. Менделеева Синтетические моющие средства
Синтетические моющие средства Углеводы. Молекулярные формулы
Углеводы. Молекулярные формулы