Содержание
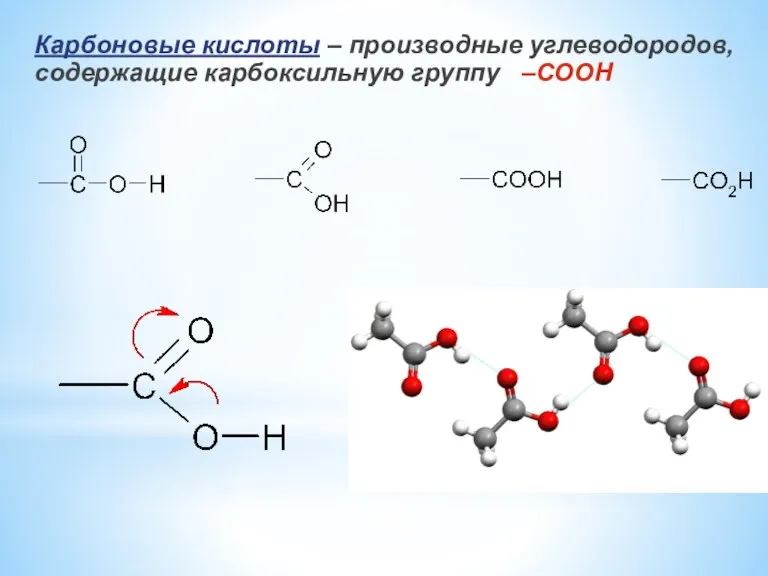
- 2. Карбоновые кислоты – производные углеводородов, содержащие карбоксильную группу –COOH
- 3. Номенклатура кислот и кислотных остатков Карбоновые кислоты с числом атомов углерода выше шести называют высшими (жирными)
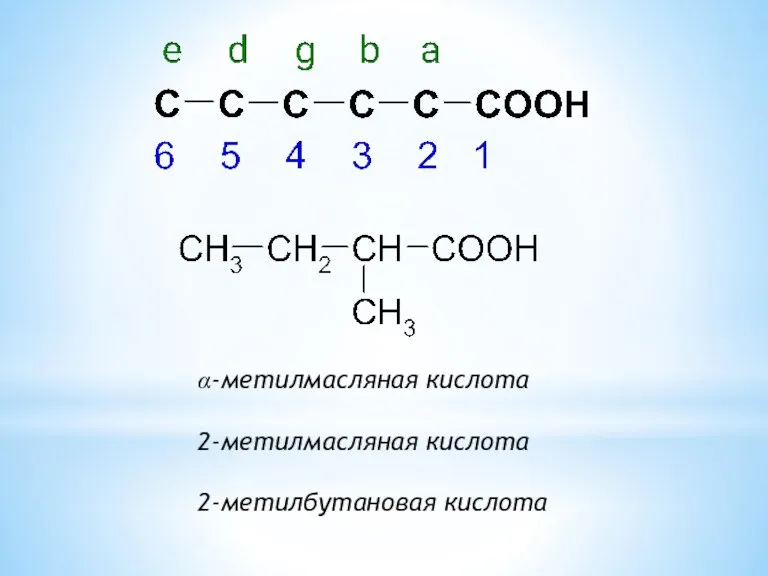
- 4. α-метилмасляная кислота 2-метилмасляная кислота 2-метилбутановая кислота
- 5. Названия солям обычно дают, используя тривиальные названия: Пример: HCOONH4 – формиат аммония CH3COONa – ацетат натрия,
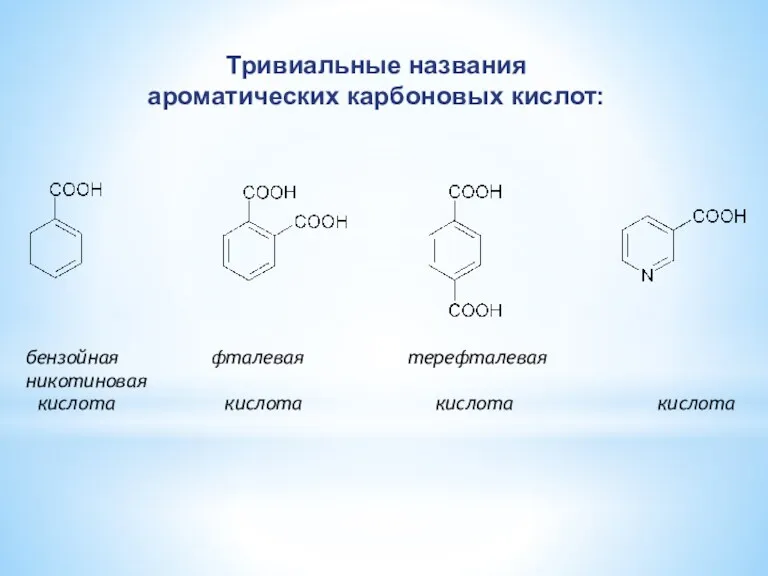
- 6. бензойная фталевая терефталевая никотиновая кислота кислота кислота кислота Тривиальные названия ароматических карбоновых кислот:
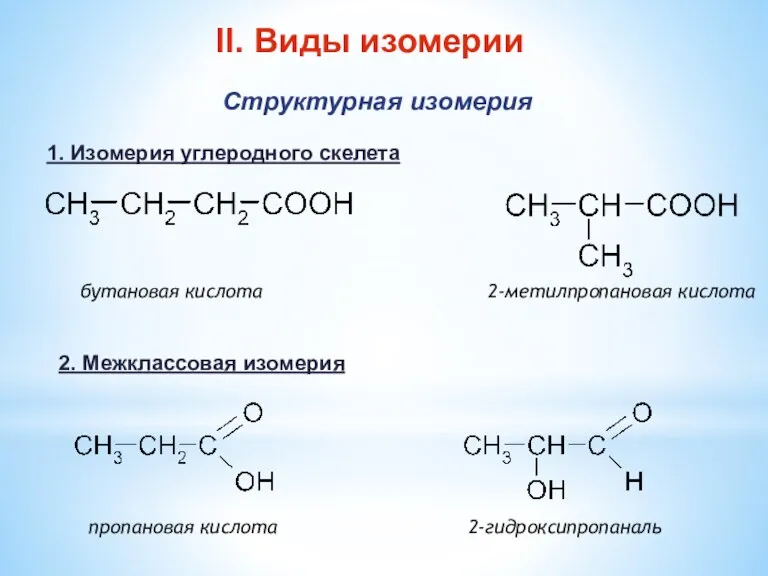
- 7. бутановая кислота 2-метилпропановая кислота пропановая кислота 2-гидроксипропаналь II. Виды изомерии Структурная изомерия 1. Изомерия углеродного скелета
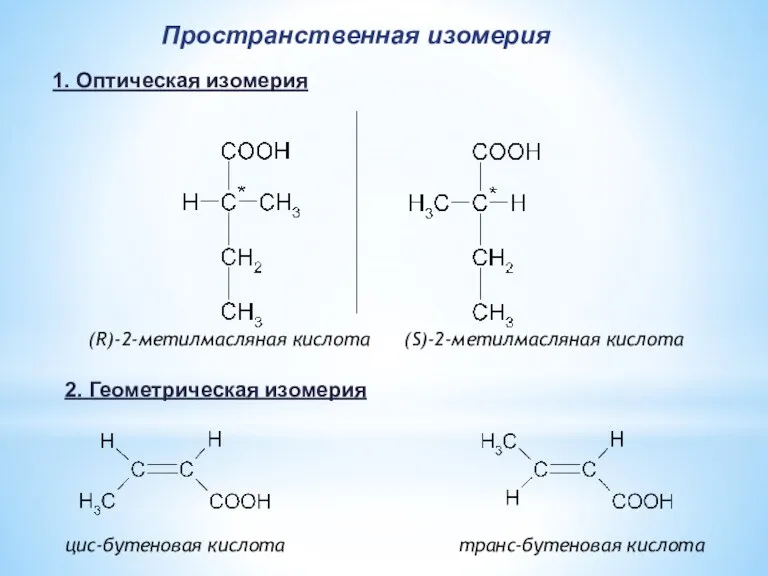
- 8. (R)-2-метилмасляная кислота (S)-2-метилмасляная кислота цис-бутеновая кислота транс-бутеновая кислота Пространственная изомерия 1. Оптическая изомерия 2. Геометрическая изомерия
- 9. Низшие жирные кислоты представляют собой легкоподвижные жидкости, средние члены ряда – масла, высшие – твёрдые кристаллические
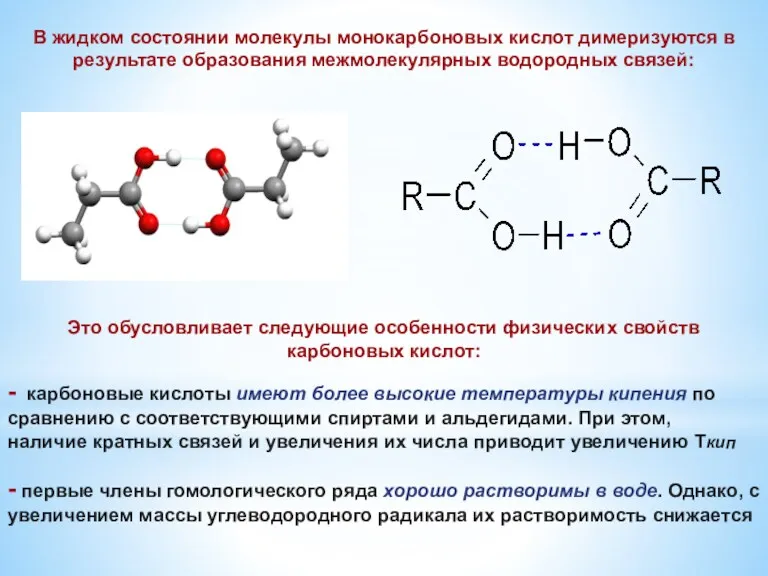
- 10. В жидком состоянии молекулы монокарбоновых кислот димеризуются в результате образования межмолекулярных водородных связей: Это обусловливает следующие
- 11. Карбоксильная группа восстанавливается с большим трудом. Для того чтобы восстановить карбоновую кислоту до углеводорода требуется длительное
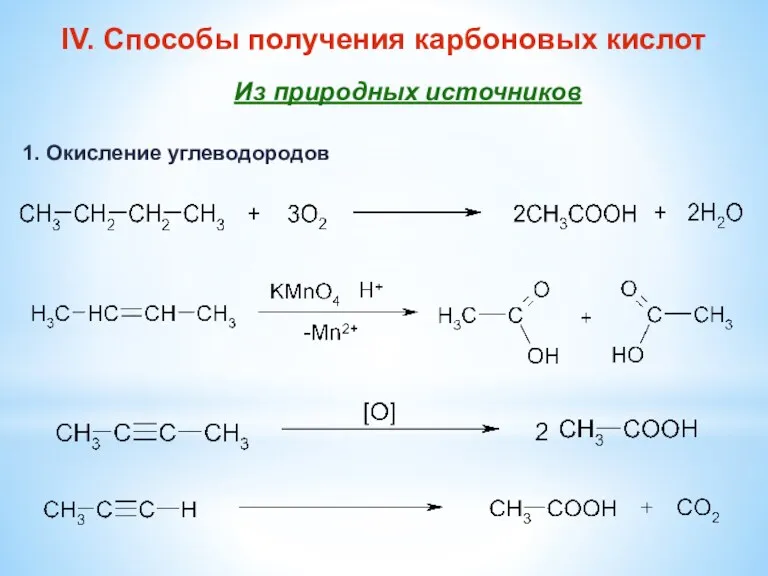
- 12. IV. Способы получения карбоновых кислот Из природных источников 1. Окисление углеводородов
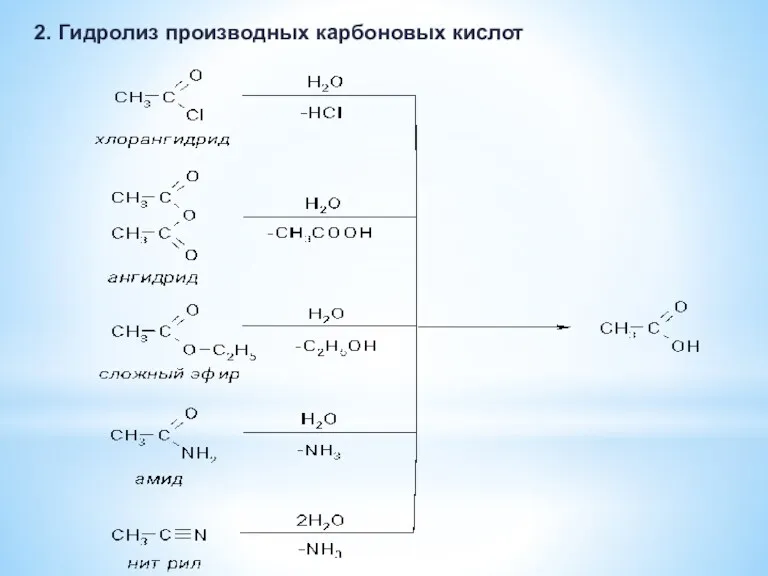
- 13. 2. Гидролиз производных карбоновых кислот
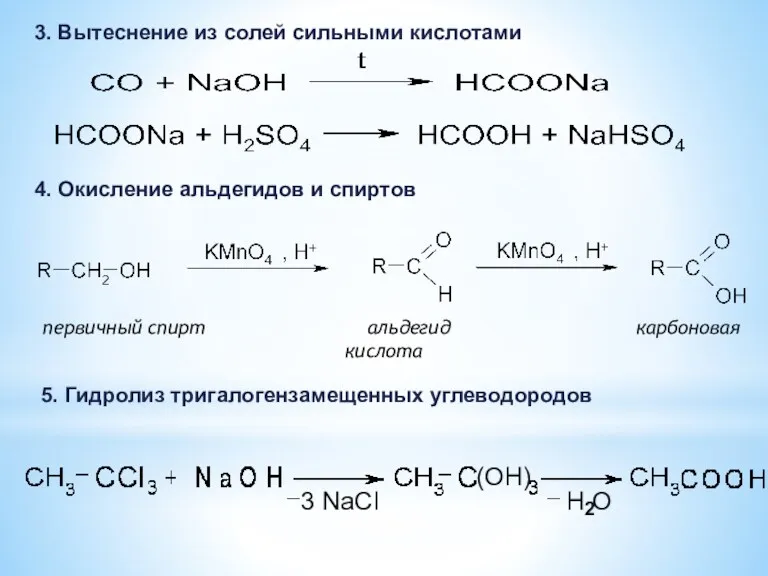
- 14. 3. Вытеснение из солей сильными кислотами 4. Окисление альдегидов и спиртов первичный спирт альдегид карбоновая кислота
- 15. 6. Гидролиз нитрилов Br + NaCN CN + Na Br 7. Синтез с реактивом Гриньяра R-MgBr
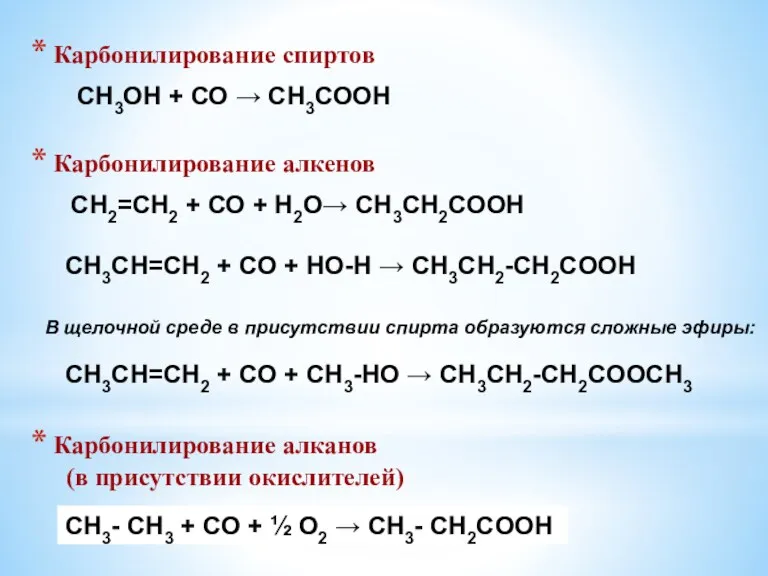
- 16. СН2=СН2 + СО + Н2О→ СН3СН2СООН Карбонилирование спиртов Карбонилирование алкенов СН3ОН + СО → СН3СООН CH3CH=CH2
- 18. Скачать презентацию





 Спирти та їх види
Спирти та їх види Циклические углеводороды. Циклоалканы
Циклические углеводороды. Циклоалканы Природный газ
Природный газ Материалы и изделия на основе полимеров. Лекция 16
Материалы и изделия на основе полимеров. Лекция 16 Introduction to Periodic Table
Introduction to Periodic Table Лихеоиндикация. Экологические аспекты переработки полимеров
Лихеоиндикация. Экологические аспекты переработки полимеров Введение в токсикологическую химию. Объекты химико-токсикологического исследования
Введение в токсикологическую химию. Объекты химико-токсикологического исследования Относительная атомная масса
Относительная атомная масса Предпосылки открытия периодического закона
Предпосылки открытия периодического закона Метод окислительно-восстановительного титрования (лекция 7)
Метод окислительно-восстановительного титрования (лекция 7) Карбоновые кислоты
Карбоновые кислоты Минералдар. Минералдардын жіктелуі
Минералдар. Минералдардын жіктелуі Поливинилхлорид. Общие сведения
Поливинилхлорид. Общие сведения Дисперсные системы: общая характеристика и классификация
Дисперсные системы: общая характеристика и классификация Основные классы органических соединений и их роль в живых организмах
Основные классы органических соединений и их роль в живых организмах Аминокислоты. Производные карбоновых кислот,
Аминокислоты. Производные карбоновых кислот, Резина и её свойства . Полимеры и их использование
Резина и её свойства . Полимеры и их использование Nuclear Energy, Controlled Fission and Fusion 2016
Nuclear Energy, Controlled Fission and Fusion 2016 Основания. Названия оснований
Основания. Названия оснований Алюминий и его соединения
Алюминий и его соединения Амины
Амины Типы химических реакций. Опыты
Типы химических реакций. Опыты Растворы
Растворы Общие свойства металлов
Общие свойства металлов Растворимость. Равновесие системы осадок-раствор
Растворимость. Равновесие системы осадок-раствор Законы химической термодинамики. Часть 1. Физическая и коллоидная химия
Законы химической термодинамики. Часть 1. Физическая и коллоидная химия Обмен индивидуальных аминокислот
Обмен индивидуальных аминокислот Мінеральні добрива та їх класифікація
Мінеральні добрива та їх класифікація