Содержание
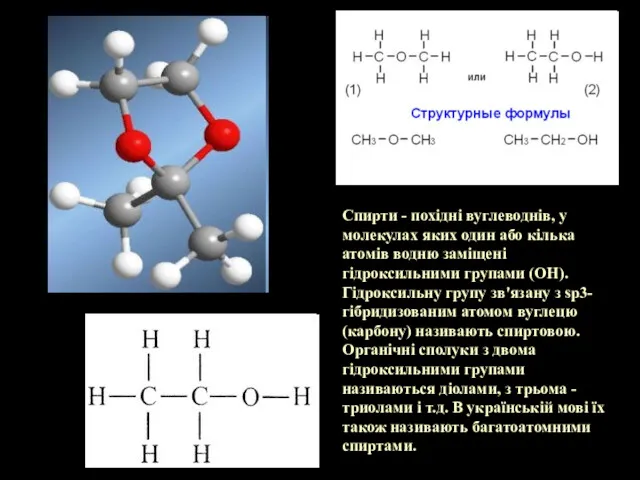
- 2. Спирти - похідні вуглеводнів, у молекулах яких один або кілька атомів водню заміщені гідроксильними групами (OH).
- 3. Етиловий спирт, вірніше рослинний хмільний напій, що його містить, був відомий людству з глибокої давнини. Вважається,
- 4. Класифікація спиртів Якщо до складу молекули спирту входить одна гідроксильна група, то такий спирт називають одноатомним,
- 5. Класифікація спиртів Назви спиртів походять від назв вуглеводневих радикалів, що входять до складу молекули спиртів. Міжнародні
- 6. Метанол інші назви: метиловий спирт, карбінол, деревний спирт; формула: CH3OH — найпростіший одноатомний спирт, безбарвна рідина
- 7. Етанол — це сильна психоактивна речовина і один з найстаріших наркотиків, протоплазматична отрута; головна діюча складова
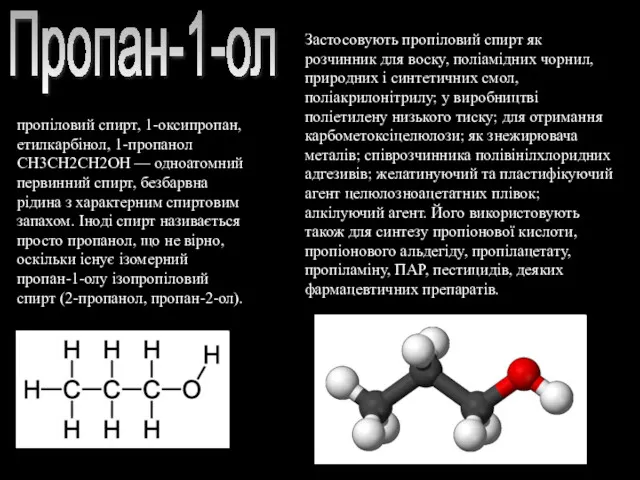
- 8. Пропан-1-ол пропіловий спирт, 1-оксипропан, етилкарбінол, 1-пропанол СН3СН2СН2ОН — одноатомний первинний спирт, безбарвна рідина з характерним спиртовим
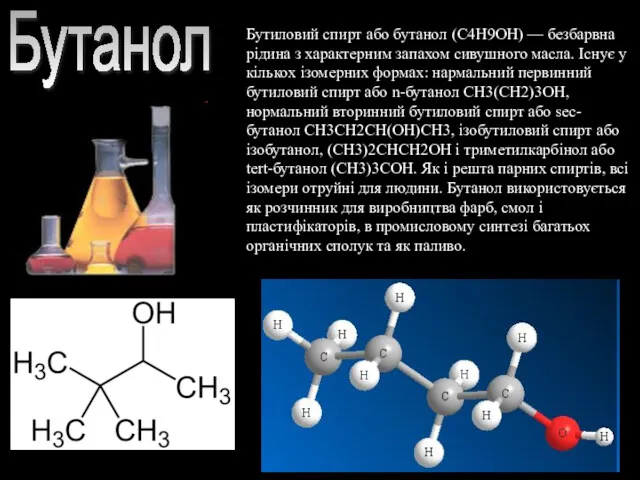
- 9. Бутанол Бутиловий спирт або бутанол (C4H9OH) — безбарвна рідина з характерним запахом сивушного масла. Існує у
- 10. Реакції спиртів Кислотно-основні властивості Характерною хімічною властивістю спиртів є їх здатність взаємодіяти з лужними металами і
- 11. Реакції спиртів Дегідратація Для спиртів характерним є також реакції дегідратації (відщеплення води). Так, при нагріванні вище
- 12. Реакції спиртів Естерифікація Крім того, для спиртів характерні також реакції взаємодії з кислотами, внаслідок чого утворюються
- 13. Застосування спиртів Економічне значення та напрями використання спиртів Області використання спиртів численні та різноманітні, особливо враховуючи
- 14. Застосування спиртів Економічне значення та напрями використання спиртів У світі найбільше значення з алканолів мають метиловий,
- 15. Застосування спиртів Застосування спиртів як паливо Для паливних цілей в даний момент використовуються в промислових об'ємах
- 17. Скачать презентацию











 Atomic mass
Atomic mass Бытовая химия
Бытовая химия Каучук. Открытие каучука
Каучук. Открытие каучука Расчеты по химическим уравнениям
Расчеты по химическим уравнениям Окислительновосстановительные реакции (ОВР)
Окислительновосстановительные реакции (ОВР) Кремний и его соединения
Кремний и его соединения Типы химических реакций в органической химии
Типы химических реакций в органической химии Химическая связь. 8 класс
Химическая связь. 8 класс Окислительно-восстановительные реакции. Генетический ряд кальция
Окислительно-восстановительные реакции. Генетический ряд кальция Ациклические углеводороды
Ациклические углеводороды Углеводы (сахариды)
Углеводы (сахариды) Стекло. Виды стекол
Стекло. Виды стекол Физико-химические методы исследования биологически активных веществ
Физико-химические методы исследования биологически активных веществ Коррозия металлов. Методы защиты металлов от коррозии
Коррозия металлов. Методы защиты металлов от коррозии Поверхностные явления на границе раздела фаз. Хроматография, применение в медицинской практике
Поверхностные явления на границе раздела фаз. Хроматография, применение в медицинской практике Цікаві історичні факти з походження назв хімічних елементів
Цікаві історичні факти з походження назв хімічних елементів Химическая промышленность. Минеральные удобрения
Химическая промышленность. Минеральные удобрения Кислород и оксиген
Кислород и оксиген История открытия кислорода
История открытия кислорода Неорганические соединения галогенов
Неорганические соединения галогенов Выращивание кристаллов
Выращивание кристаллов Теплогенерация. Топливо и его горение
Теплогенерация. Топливо и его горение Задачи по химии
Задачи по химии Тіршілік гетерофункционалды қосылыстар
Тіршілік гетерофункционалды қосылыстар Основи. Властивості, застосування гідроксидів Натрію і Калію
Основи. Властивості, застосування гідроксидів Натрію і Калію Бериллий, магний и щелочноземельные металлы
Бериллий, магний и щелочноземельные металлы Коллигативные свойства растворов неэлектролитов
Коллигативные свойства растворов неэлектролитов Методы выделения и очистки продуктов биотехнологических производств
Методы выделения и очистки продуктов биотехнологических производств