Содержание
- 2. Вопросы: Предельные углеводороды: строение, свойства, применение. 2. Алкены: строение, свойства, применение. 3. Алкины: строение, свойства, применение.
- 3. Алканы (парафины) - это углеводороды, в которых атомы углерода соединены друг с другом простыми (одинарными) связями,
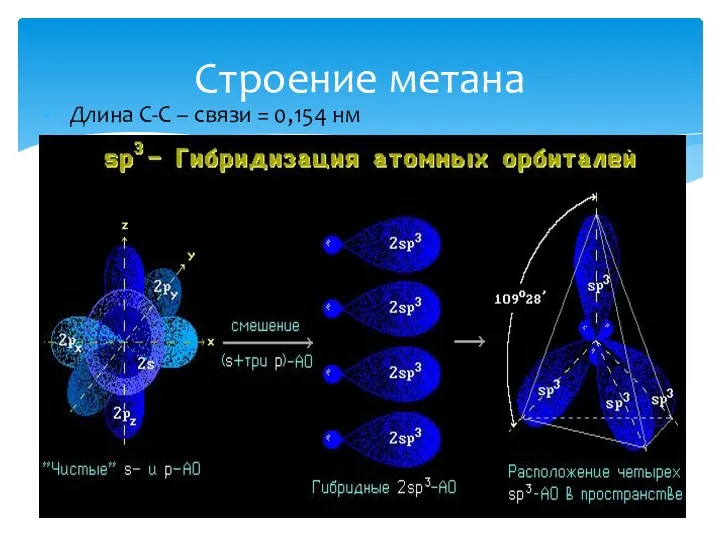
- 4. Строение метана Длина С-С – связи = 0,154 нм
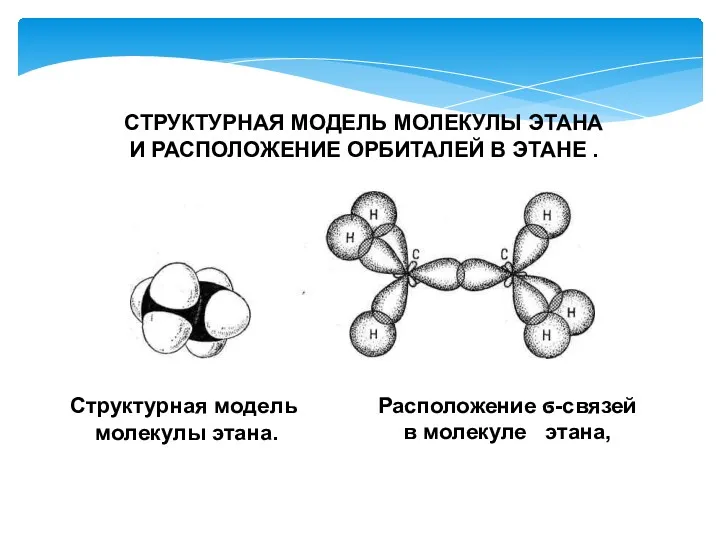
- 5. Расположение ϭ-связей в молекуле этана, СТРУКТУРНАЯ МОДЕЛЬ МОЛЕКУЛЫ ЭТАНА И РАСПОЛОЖЕНИЕ ОРБИТАЛЕЙ В ЭТАНЕ . Структурная
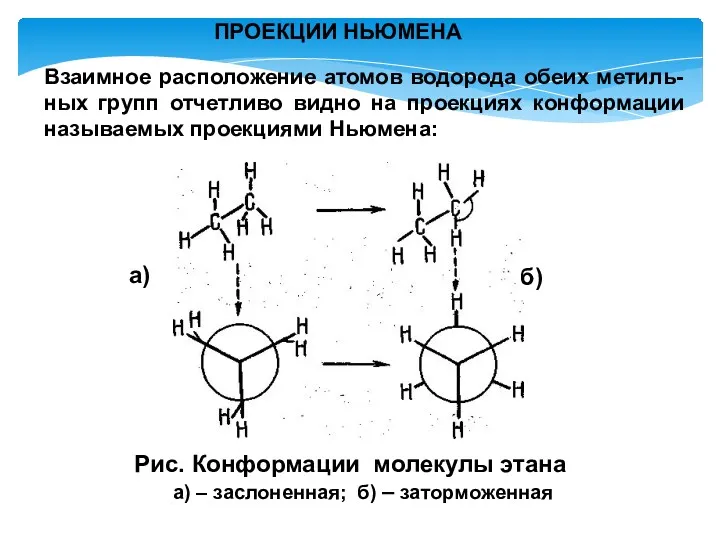
- 7. Для молекулы этана возможны две крайние конформации. В одной из них атомы водорода метильных групп расположены
- 8. Рис. Конформации молекулы этана а) – заслоненная; б) – заторможенная Взаимное расположение атомов водорода обеих метиль-ных
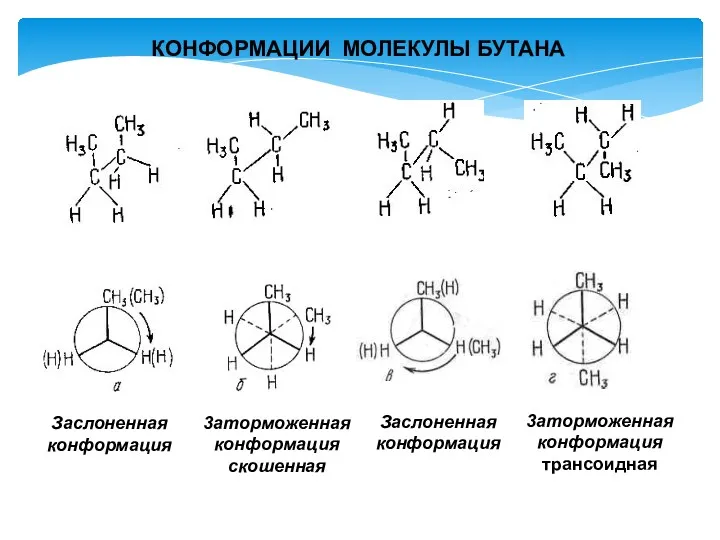
- 9. 3аторможенная конформация скошенная Заслоненная конформация Заслоненная конформация 3аторможенная конформация трансоидная КОНФОРМАЦИИ МОЛЕКУЛЫ БУТАНА
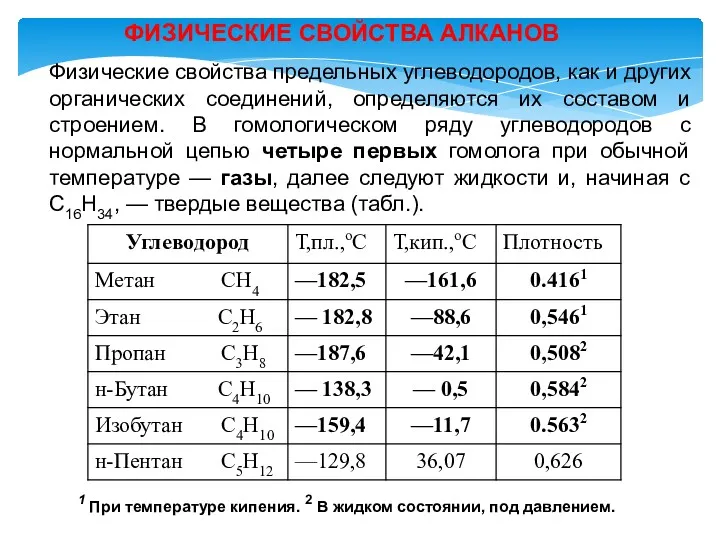
- 10. ФИЗИЧЕСКИЕ СВОЙСТВА АЛКАНОВ Физические свойства предельных углеводородов, как и других органических соединений, определяются их составом и
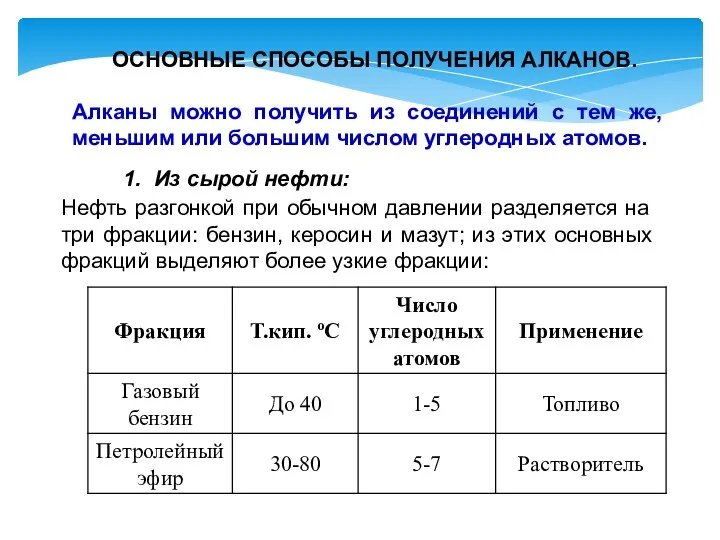
- 11. ОСНОВНЫЕ СПОСОБЫ ПОЛУЧЕНИЯ АЛКАНОВ. Алканы можно получить из соединений с тем же, меньшим или большим числом
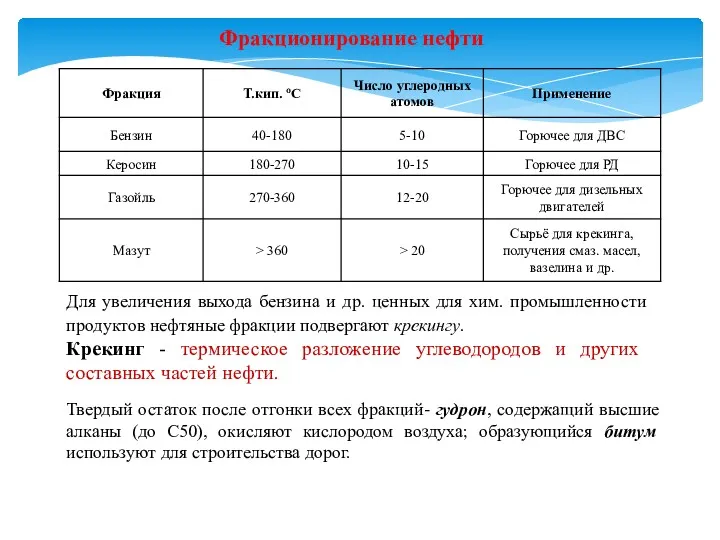
- 12. Фракционирование нефти Для увеличения выхода бензина и др. ценных для хим. промышленности продуктов нефтяные фракции подвергают
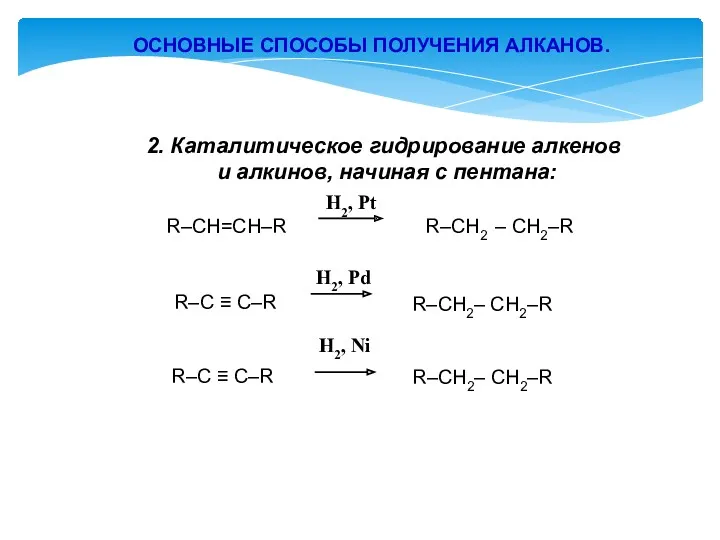
- 13. ОСНОВНЫЕ СПОСОБЫ ПОЛУЧЕНИЯ АЛКАНОВ. 2. Каталитическое гидрирование алкенов и алкинов, начиная с пентана: R–CH=CH–R R–CH2 –
- 14. ОСНОВНЫЕ СПОСОБЫ ПОЛУЧЕНИЯ АЛКАНОВ. 3. Восстановление галогенопроизводных R-X а) R-X R-H + HX H2/Pt б) R-X
- 15. 4. Реакция Вюрца: ОСНОВНЫЕ СПОСОБЫ ПОЛУЧЕНИЯ АЛКАНОВ. 2C2H5I + 2Na С2Н5– С2Н5 + 2NaI возможный механизм:
- 16. Синтез Фишера-Тропша nCO + (2n+1)H2→CnH2n+2 + H2O Процесс Фишера — Тропша — это химическая реакция, происходящая
- 17. Химические свойства Реакции радикального замещения а)галогенирование. В первую очередь галогенируется наименее гидрированый атом углерода (третичный атом,
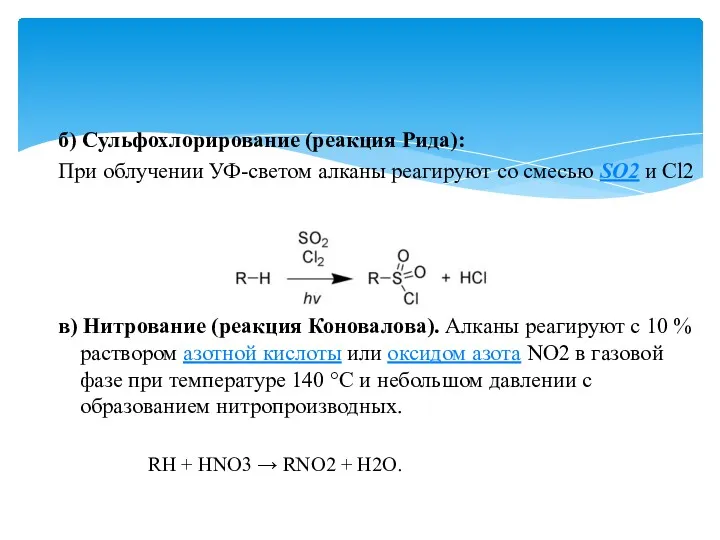
- 18. б) Сульфохлорирование (реакция Рида): При облучении УФ-светом алканы реагируют со смесью SO2 и Cl2 в) Нитрование
- 19. Реакции окисления а) Горение СnН2n+2 +(1,5n+0,5)O2 → nCO2+ (n+1)H 2O б) Каталитическое окисление При мягком окислении
- 20. Термические превращения Для метана: CH4 → С + 2H2 — при 1000 °C. Частичный крекинг: 2CH4
- 21. Реакция разложения При повышении температуры до 550-6500 С происходит более глубокое расщепление – пиролиз. В результате
- 22. Получение синтез-газа. а) Взаимодействие СH4 с водой; СH4 +H2O → СO+3H2 синтез-газ б) взаимодействием СH4 с
- 23. Применение Получение ацетилена Горючее для дизельных и турбореактивных двигателей Получение растворителей В металлургии А также сырьё
- 24. Применение алканов 1-3 – производство сажи (1 – картрижи; 2 – резина; 3 – типографическая краска)
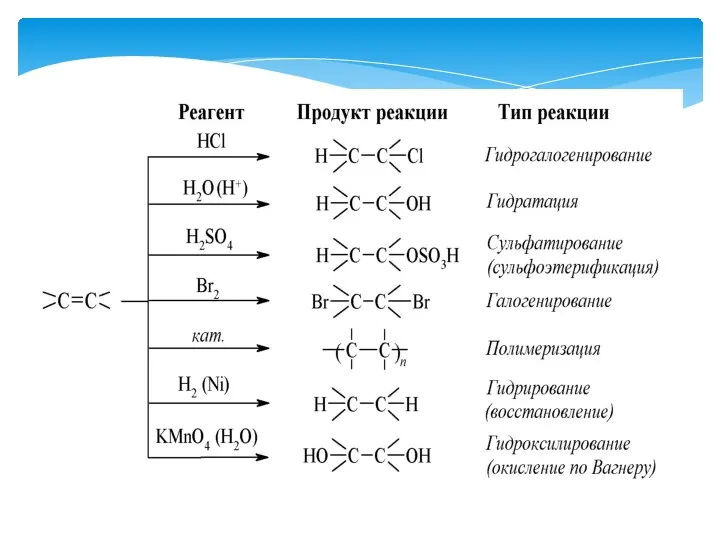
- 25. Алкены – углеводороды, содержащие в молекуле одну двойную связь между атомами углерода, а качественный и количественный
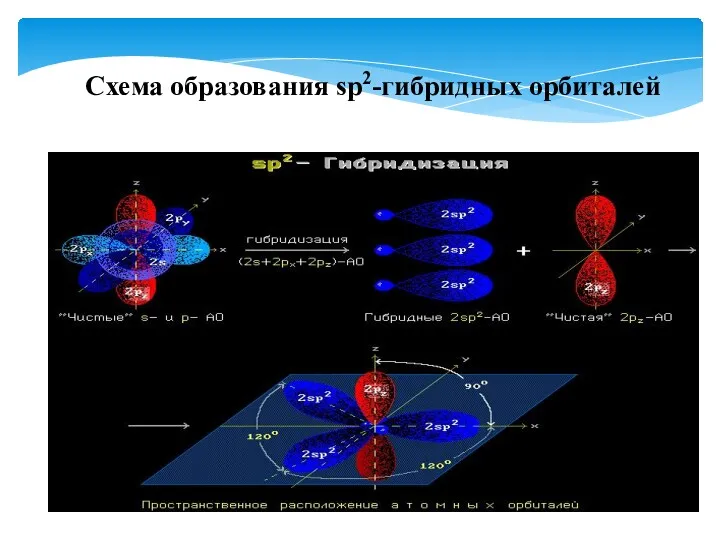
- 26. Схема образования sp2-гибридных орбиталей
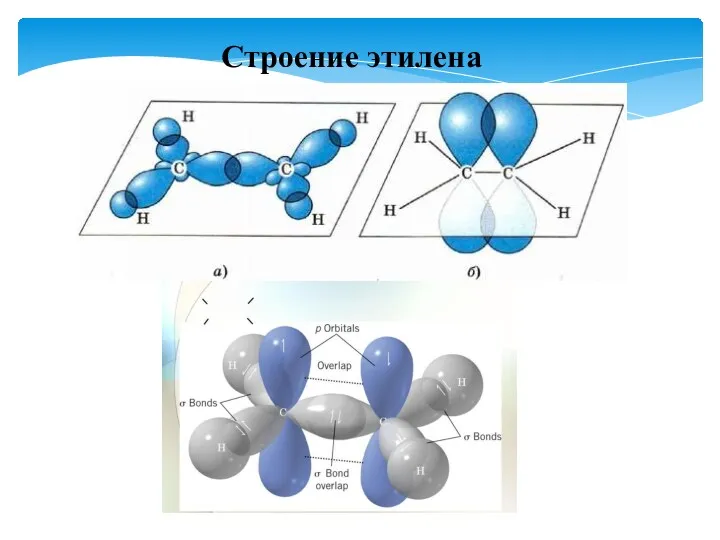
- 27. Строение этилена
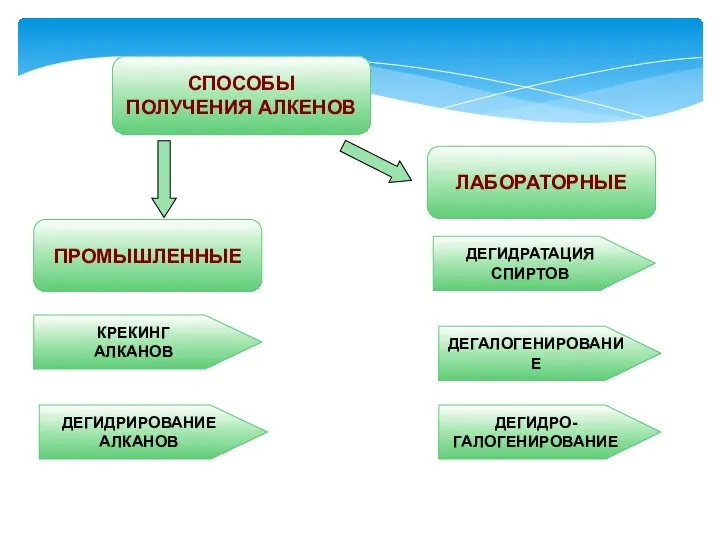
- 30. ПРОМЫШЛЕННЫЕ СПОСОБЫ ПОЛУЧЕНИЯ АЛКЕНОВ ЛАБОРАТОРНЫЕ КРЕКИНГ АЛКАНОВ ДЕГИДРИРОВАНИЕ АЛКАНОВ ДЕГИДРАТАЦИЯ СПИРТОВ ДЕГАЛОГЕНИРОВАНИЕ ДЕГИДРО- ГАЛОГЕНИРОВАНИЕ
- 33. Применение этилена
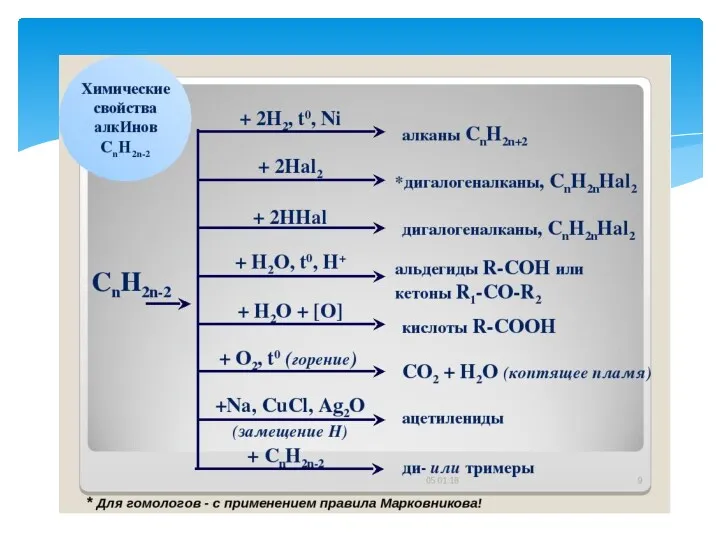
- 35. АЛКИНЫ Алки́ны (ацетиленовые углеводороды) — углеводороды, содержащие тройную связь между атомами углерода. Атомы углерода при тройной
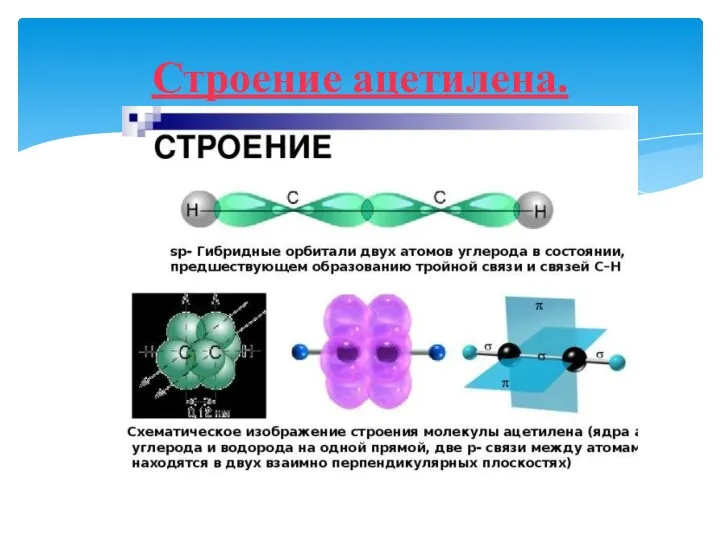
- 36. Строение ацетилена.
- 37. Изомерия алкинов. Изомерия положения тройной связи (начиная с С4Н6): Изомерия углеродного скелета ( с С5Н8): Межклассовая
- 38. Получение. 1) В промышленноси ацетилен получают высокотемпературным пиролизом метана. 1500ºС 2CH4 → HC≡CH + 3H2 2)
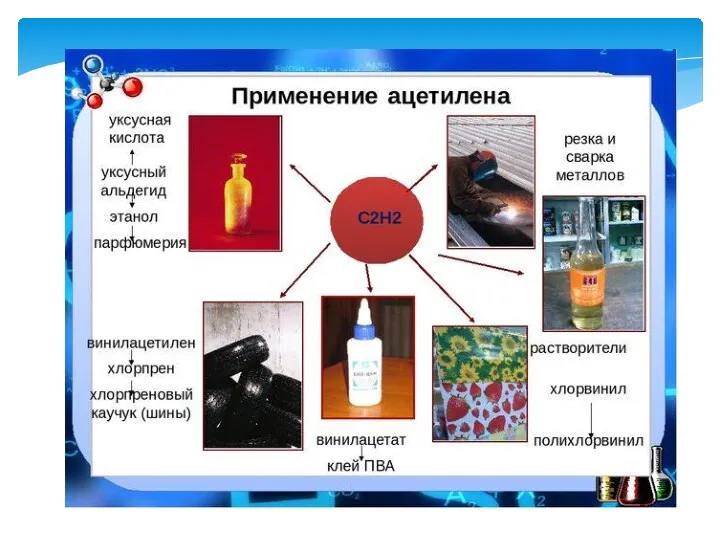
- 39. Физические свойства. При обычных условиях алкины С2Н2-С4Н6 – газы, С5Н8-С16Н30 – жидкости, с С17Н32 – твердые
- 43. Скачать презентацию























 Базиты. Химический состав
Базиты. Химический состав Алкены
Алкены Оптические свойства дисперсных систем. Оптические методы исследования коллоидных систем
Оптические свойства дисперсных систем. Оптические методы исследования коллоидных систем Методы титрования. Перманганатометрия. (Лекция 24)
Методы титрования. Перманганатометрия. (Лекция 24) Азот. Характеристика азота, фосфора (9класс)
Азот. Характеристика азота, фосфора (9класс) Механизмы органических реакций
Механизмы органических реакций Химическая связь. Взаимное влияние атомов в молекуле. Классификация реакций и реагентов. Структура и функции биолекул
Химическая связь. Взаимное влияние атомов в молекуле. Классификация реакций и реагентов. Структура и функции биолекул Щелочные металлы
Щелочные металлы Характеристика строения и свойств химических элементов
Характеристика строения и свойств химических элементов Сполуки основних класів у будівництві і побуті
Сполуки основних класів у будівництві і побуті Подгруппа серы и ее соединения
Подгруппа серы и ее соединения Распределение электронов в атомах. 8 класс
Распределение электронов в атомах. 8 класс Металлические и неметаллические свойства химических элементов
Металлические и неметаллические свойства химических элементов Алканы нефти. Содержание алканов в нефтяных фракциях
Алканы нефти. Содержание алканов в нефтяных фракциях Создание пилотной производства 500 тонн в год рафинированного металлургического кремния Si 99,99% для нужд солнечной энергетики
Создание пилотной производства 500 тонн в год рафинированного металлургического кремния Si 99,99% для нужд солнечной энергетики Химия биогенных элементов p -блока
Химия биогенных элементов p -блока Химические элементы As, Sb, Bi
Химические элементы As, Sb, Bi Графен: синтез, будова та властивості двовимірних вуглецевих матеріалів
Графен: синтез, будова та властивості двовимірних вуглецевих матеріалів Механические свойства минералов
Механические свойства минералов Кислоты, их состав и названия
Кислоты, их состав и названия Алюминий на кухне - опасный враг или верный помощник
Алюминий на кухне - опасный враг или верный помощник Алюминий и его соединения
Алюминий и его соединения Флокуляційне очищення питної води за допомогою катіонних та аніонних флокулянтів
Флокуляційне очищення питної води за допомогою катіонних та аніонних флокулянтів Жаңа дәрілерді жасау
Жаңа дәрілерді жасау Важнейшие органические вещества пищевых продуктов. Жиры.(Липиды)
Важнейшие органические вещества пищевых продуктов. Жиры.(Липиды) Формы минералов и их агрегатов
Формы минералов и их агрегатов Соли. Классификация и свойства солей
Соли. Классификация и свойства солей Воздух и его состав. Урок-презентация. 8 класс
Воздух и его состав. Урок-презентация. 8 класс