Содержание
- 2. ПОДГРУППА СЕРЫ План урока: 1. Характеристика подгруппы серы. 2. Физические свойства серы. 3. Аллотропные видоизменения серы.
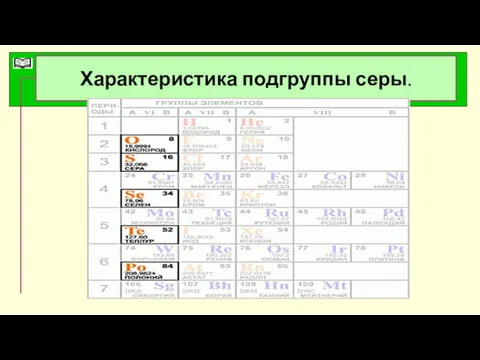
- 3. Характеристика подгруппы серы.
- 4. Характеристика подгруппы серы. Определите в каком приведенном ниже примере изображено заполнение электронов для атома серы
- 5. Характеристика подгруппы серы Сера может иметь валентность:Ⅱ, Ⅳ, Ⅵ. Объясните в каких случаях и за счет
- 6. АЛЛОТРОПНЫЕ МОДИФИКАЦИИ СЕРЫ Сера ромбическая Сера моноклинная Цвет – лимонно-желтый; tпл. = 112,8ºС; ρ = 2,07г/см3
- 7. АЛЛОТРОПНЫЕ МОДИФИКАЦИИ СЕРЫ Сера пластическая Цвет – темно-коричневый;tпл.= 444,6ºС; ρ = 1,96г/см3 При нормальных условиях все
- 8. Физические свойства серы На столах выдан кусочек серы опишите его физические свойства по плану: Цвет Агрегатное
- 9. Предположите в какие реакции может вступать сера. Алгоритм к действию: Помните что сера может проявлять валентность
- 10. Химические свойства серы Проверьте свои предположения: S+O2 → SO2 (оксид серы IV) S+ 2Na→ Na2S сульфид
- 11. ХИМИЧЕСКИЕ СВОЙСТВА СЕРЫ Восстановительные свойства серы проявляются в реакциях серы и с другими неметаллами, однако при
- 12. ПОЛУЧЕНИЕ СЕРЫ Неполное окисление сероводорода: 2H2S + O2 = 2S↓ + 2H2O (недостаток O2). 2. Реакция
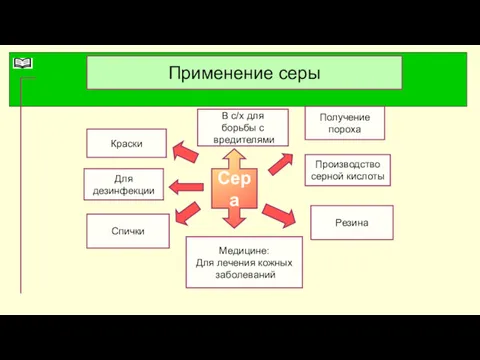
- 13. Применение серы Краски Для дезинфекции Получение пороха Медицине: Для лечения кожных заболеваний Спички Резина В с/х
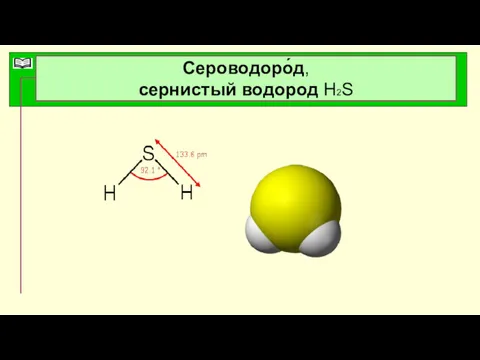
- 14. Сероводоро́д, сернистый водород Н2S
- 15. Сероводоро́д, сернистый водород Н2S Общие Систематическое наименование сероводород / hydrogen sulphide Химическая формула H2S Отн. молек.
- 16. Сероводоро́д, сернистый водород Н2S Термические свойства Температура плавления-82.30 °C Температура кипения-60.28 °C Химические свойства pKa6.89, 19±2
- 17. Сероводоро́д, сернистый водород Н2S Бесцветный газ с неприятным запахом (тухлого яйца) и сладковатым вкусом. Плохо растворим
- 18. Сероводоро́д Н2S Физические свойства Термически неустойчив (при температурах больше 400 °C разлагается на простые вещества —
- 19. Сероводоро́д Н2S Химические свойства В воде сероводород мало растворим, водный раствор H2S является очень слабой кислотой:
- 20. Сероводоро́д Н2S Химические свойства при недостатке кислорода: 2H2S + O2 = 2S + 2H2O (на этой
- 21. H2S-2 + Br2 → S0 + 2HBr H2S-2 + 2FeCl3 → 2FeCl2 + S0 + 2HCl
- 22. 5) Серебро при контакте с сероводородом чернеет: 4Ag + 2H2S + O2 → 2Ag2S↓ + 2H2O
- 23. PbCO3 + H2S = PbS↓ + CO2 + H2O При обработке сульфида свинца (II) пероксидом водорода
- 24. Применеие сероводорода Н2S Сероводород из-за своей токсичности находит ограниченное применение. В аналитической химии сероводород и сероводородная
- 25. Применеие сероводорода Н2S Сероводород применяют для получения серной кислоты, элементной серы, сульфидов Используют в органическом синтезе
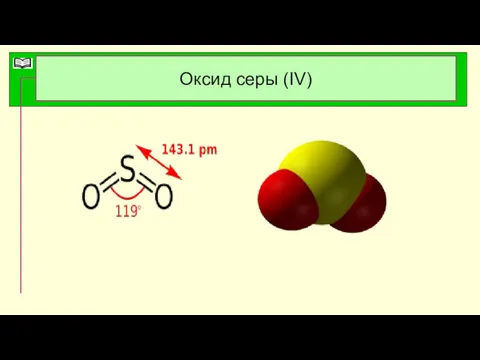
- 26. Оксид серы (IV)
- 27. Оксид серы (IV) Общие свойства Систематическое наименование Оксид серы(IV) Химическая формула SO2 Относительная молекулярная масса 64.054
- 28. Оксид серы (IV) Термические свойства Температура плавления−75,5 °C Температура кипения−10,01 °C Химические свойства Растворимость в воде11,5
- 29. Химические свойства оксида серы (IV) Относится к кислотным оксидам. Растворяется в воде с образованием сернистой кислоты
- 30. Химические свойства оксида серы (IV) Данная реакция является качественной реакцией на сульфит-ион SO32- и на SO2
- 31. Сернистая кислота H2SO3 Неустойчивая двухосновная кислота средней силы, существует лишь в разбавленных водных растворах (в свободном
- 32. Химические свойства Сернистой кислоты H2SO3 Кислота средней силы: Растворы H2SO3 всегда имеют резкий специфический запах (похожий
- 33. Применение Сернистой кислоты H2SO3 Сернистая кислота и её соли применяют как восстановители, для беления шерсти, шелка
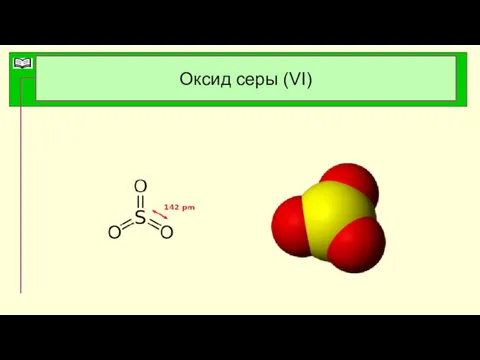
- 34. Оксид серы (VI)
- 35. Оксид серы (VI) Общие свойства Систематическое наименование Оксид серы(VI) Химическая формула SO3 Отн. молек. Масса 80.06
- 36. Оксид серы (VI) Физические свойства Окси́д се́ры(VI) (се́рный ангидри́д, трео́кись се́ры, се́рный га́з) SO3 — высший
- 37. Оксид серы (VI) При переходе в жидкое и кристаллическое состояния образуются циклический тример и зигзагообразные цепи.
- 38. Получение оксида серы (VI) Получают, окисляя оксид серы(IV) кислородом воздуха при нагревании, в присутствии катализатора (V2O5,
- 39. Оксид серы (VI) Химические свойства 1. Кислотно-основные: SO3 — типичный кислотный оксид, ангидрид серной кислоты. Его
- 40. Оксид серы (VI) Химические свойства 2. Окислительно-восстановительные: SO3 характеризуется сильными окислительными свойствами, восстанавливается, обычно, до сернистого
- 41. Серная кислота и её соли Цель урока: углубить понятие о кислотах на примере серной кислоты, продолжать
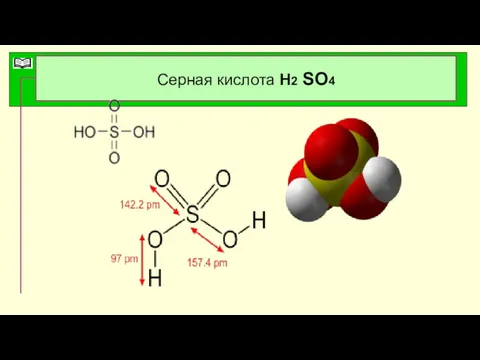
- 42. Серная кислота Н2 SO4
- 43. План урока Физические свойства серной кислоты Структурная формула серной кислоты Химические свойства серной кислоты Получение серной
- 44. Физические свойства серной кислоты Структурная формула серной кислоты Серная кислота – бесцветная , маслянистая, тяжелая жидкость.
- 45. Серная кислота Н2 SO4 Общие свойства Систематическое наименование серная кислота Химическая формула H2SO4 Отн. молек. Масса
- 46. Физические свойства серной кислоты Н2SO4 Се́рная кислота́ H2SO4 — сильная двухосновная кислота, отвечающая высшей степени окисления
- 47. Химические свойства серной кислоты Н2 SO4 Серная кислота - сильная двухосновная кислота, диссоциация ее протекает по
- 48. Химические свойства серной кислоты Перечислите с какими классами соединений реагируют все кислоты: Составьте уравнения реакций по
- 49. Химические свойства серной кислоты Н2 SO4 Серная кислота - сильнейшее дегидратирующее (водоотнимающее) вещество. Она поглощает влагу
- 50. Качественная реакция на сульфат ионы
- 51. Химические свойства серной кислоты Н2 SO4 В окислительно-восстановительных реакциях разбавленная серная кислота проявляет свойства обычной кислоты
- 52. Химические свойства серной кислоты Н2 SO4 Серная кислота проявляет все свойства сильных кислот: а) взаимодействует с
- 53. Химические свойства серной кислоты Н2 SO4 или более летучие (обладающие температурами кипения ниже, чем у серной
- 54. Химические свойства серной кислоты Н2 SO4 Железо, алюминий, хром концентрированной серной кислотой пассивируются, однако при сильном
- 55. Задания для самостоятельной работы: Напишите уравнения взаимодействия разбавленной серной кислоты с металлами; основными оксидами; амфотерными оксидами;
- 56. Соли серной кислоты Серная кислота как двухосновная кислота образует два ряда солей - кислые - гидросульфаты
- 57. Соли серной кислоты Сульфаты при нагревании разлагаются (кроме сульфатов щелочных металлов, которые термически устойчивы), например CaSO4
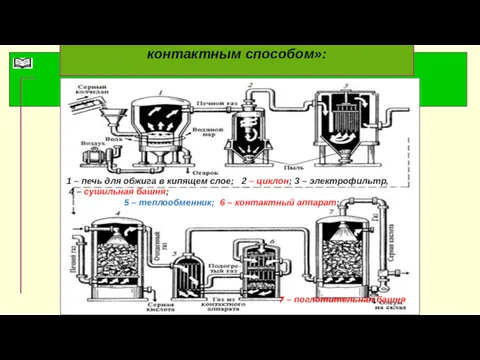
- 58. Производство серной кислоты Сырьём для получения серной кислоты служат сера, сульфиды металлов, сероводород, отходящие газы теплоэлектростанций,
- 59. Производство серной кислоты Реакции по производству серной кислоты из минерала пирита на катализаторе — оксиде ванадия
- 60. Применение серной кислоты В производстве минеральных удобрений; как электролит в свинцовых аккумуляторах; для получения различных минеральных
- 61. Применение серной кислоты дегидратации (получение диэтилового эфира, сложных эфиров); гидратации (этанол из этилена); сульфирования (синтетические моющие
- 62. Исторические сведения о серной кислоте Серная кислота известна с древности. Первое упоминание о кислых газах, получаемых
- 63. Исторические сведения о серной кислоте В XV веке алхимики обнаружили, что серную кислоту можно получить, сжигая
- 64. Дополнительные сведения о серной кислоте Мельчайшие капельки серной кислоты могут образовываться в средних и верхних слоях
- 65. Схема «Производство серной кислоты контактным способом»:
- 67. Скачать презентацию

























































 Материаловедение. Силикатные материалы
Материаловедение. Силикатные материалы Алканы: физические и химические свойства, получение
Алканы: физические и химические свойства, получение Основные положения теории электролитической диссоциации
Основные положения теории электролитической диссоциации Строительное материаловедение. (Лекции 1-2)
Строительное материаловедение. (Лекции 1-2) Щелочные металлы. (9 класс)
Щелочные металлы. (9 класс) Сахароза
Сахароза Электролит және бейэлектролит ерітінділердің коллигативті қасие
Электролит және бейэлектролит ерітінділердің коллигативті қасие Химия аминокислот. Лекция № 4
Химия аминокислот. Лекция № 4 Physiology lab
Physiology lab Коррозия и защита материалов
Коррозия и защита материалов Жёсткость воды
Жёсткость воды fosfor_и его соед
fosfor_и его соед Plastics слайды
Plastics слайды Ртуть и цинк
Ртуть и цинк Кислородсодержащие органические соединения. Спирты
Кислородсодержащие органические соединения. Спирты Полимерные материалы
Полимерные материалы Биологическая химия (введение)
Биологическая химия (введение) Көмірсутектерді пиролиздеу арқылы қарапайым олефиндерді алу
Көмірсутектерді пиролиздеу арқылы қарапайым олефиндерді алу БАЗ синтездеудің химиялық технологиясы Синтетикалық түсінік
БАЗ синтездеудің химиялық технологиясы Синтетикалық түсінік Характеристика металу Алюміній
Характеристика металу Алюміній Electrolysis
Electrolysis Квест с Гарри Поттером
Квест с Гарри Поттером Методы комплексонометрии. Количественный анализ
Методы комплексонометрии. Количественный анализ Метаболизм кетоновых тел. Метаболизм холестерина
Метаболизм кетоновых тел. Метаболизм холестерина Правила ДСС
Правила ДСС кислоты
кислоты Расчеты по химическим уравнениям
Расчеты по химическим уравнениям Химия. Лекция 1. Растворы
Химия. Лекция 1. Растворы