Слайд 2

Цели урока:
1.Сформулировать основные положения теории электролитической диссоциации.
2.Закрепить понятия: ион, катион, анион,
гидратированные и негидратированные ионы.
3.Рассмотреть примеры диссоциации солей, кислот и щелочей.
Слайд 3

ПРОВЕРЬ СВОИ ЗНАНИЯ
Вещества, растворы которых проводят электрический ток, называют электролитами
Процесс распада
электролита на ионы называют электролитической диссоциацией
Вещества, растворы которых не проводят электрический ток, называют неэлектролитами
Отношение числа частиц, распавшихся на ионы, к общему числу растворенных частиц называют степенью диссоциации
Слайд 4

История открытия теории электролитической диссоциации
В 1887 году шведский химик Сванте
Аррениус сформулировал основные положения теории электролитической диссоциации
Слайд 5

Основные положения ТЭД
При растворении в воде электролиты диссоциируют (распадаются) на положительные
и отрицательные ионы.
NaCl Na+ + Cl-
Ионы – это одна из форм существования химического элемента
Слайд 6

ИОНЫ
(по составу)
ПРОСТЫЕ
Например:
Cl-
K+
СЛОЖНЫЕ
Например:
NO3-
SO42-
Слайд 7

Основные положения ТЭД
2. Причиной диссоциации электролита в водном растворе является его
гидратация, т.е. взаимодействие электролита с молекулами воды и разрыв химической связи в нем.
Слайд 8

ИОНЫ
(по наличию водной оболочки)
ГИДРАТИРОВАННЫЕ
(в растворах и кристаллогидратах)
Например:
CuSO4 * 5H2O
НЕГИДРАТИРОВАННЫЕ
(в
безводных солях)
Например:
Cu2+SO42-
Na+NO3-
Слайд 9

Основные положения ТЭД
3. Под действием электрического тока положительно заряженные ионы движутся
к отрицательному полюсу источника тока – катоду, поэтому их называют катионами, а отрицательно заряженные ионы движутся к положительному полюсу источника тока – аноду, поэтому их называют анионами.
Слайд 10

ИОНЫ
(по знаку заряда)
КАТИОНЫ
положительно заряженные частицы
АНИОНЫ
отрицательно заряженные частицы
Слайд 11
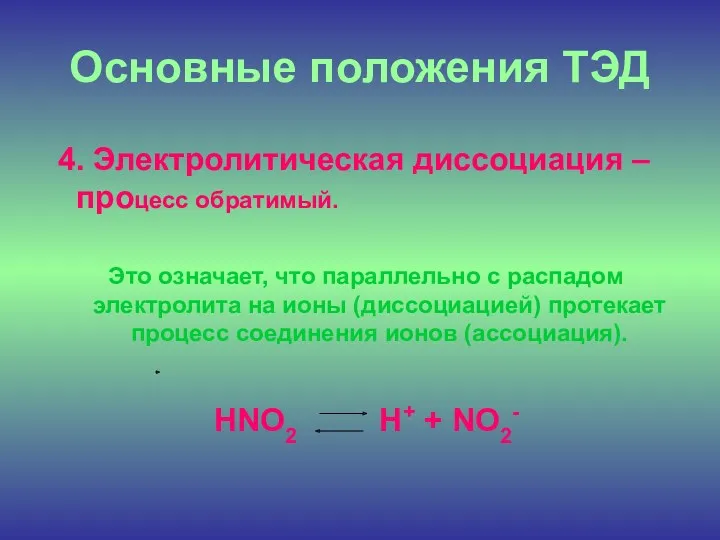
Основные положения ТЭД
4. Электролитическая диссоциация – процесс обратимый.
Это означает,
что параллельно с распадом электролита на ионы (диссоциацией) протекает процесс соединения ионов (ассоциация).
HNO2 H+ + NO2-
Слайд 12

Основные положения ТЭД
5. Не все электролиты в одинаковой мере диссоциируют
на ионы.
Слайд 13
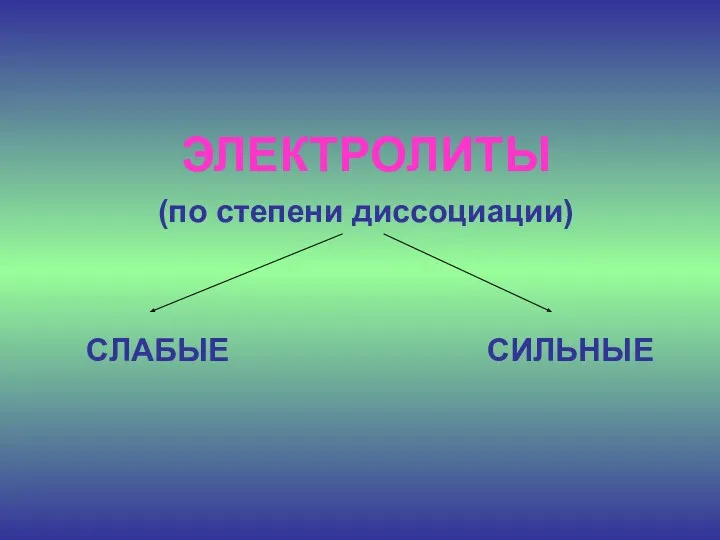
ЭЛЕКТРОЛИТЫ
(по степени диссоциации)
СЛАБЫЕ СИЛЬНЫЕ
Слайд 14

Основные положения ТЭД
6. Химические свойства растворов электролитов определяются свойствами тех ионов,
которые они образуют при диссоциации.
Слайд 15

ЭЛЕКТРОЛИТЫ
(по характеру образующихся ионов)
КИСЛОТЫ ОСНОВАНИЯ
СОЛИ
Слайд 16
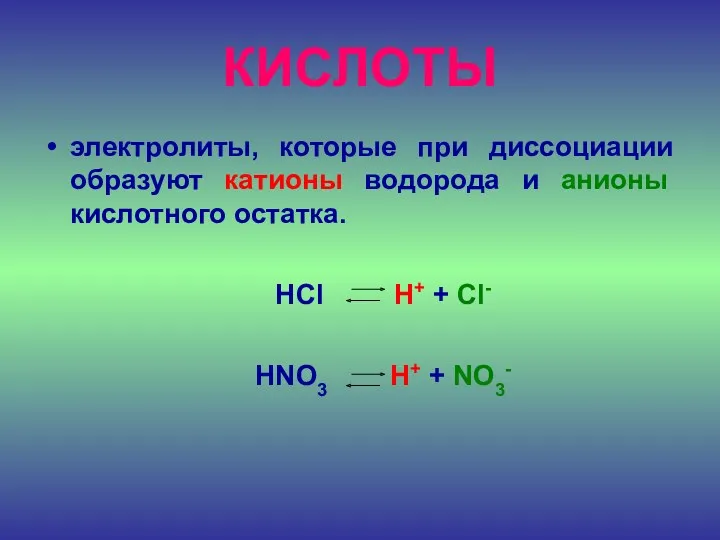
КИСЛОТЫ
электролиты, которые при диссоциации образуют катионы водорода и анионы кислотного остатка.
HCl H+ + Cl-
HNO3 H+ + NO3-
Слайд 17
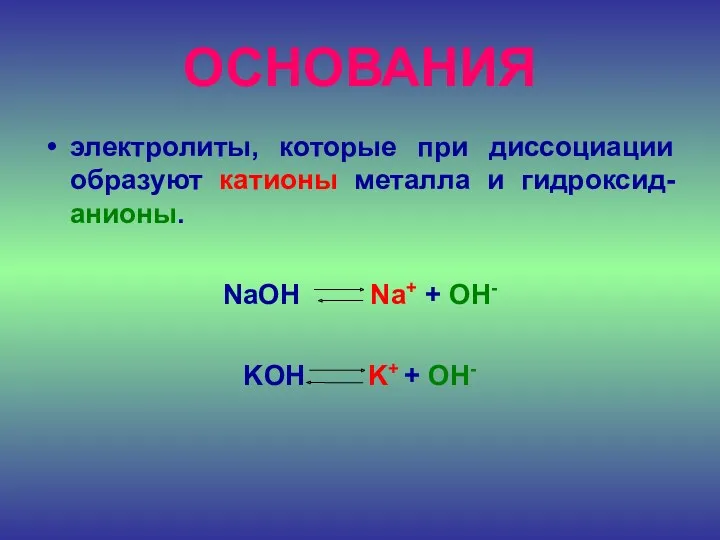
ОСНОВАНИЯ
электролиты, которые при диссоциации образуют катионы металла и гидроксид-анионы.
NaOH Na+
+ OH-
KOH K+ + OH-
Слайд 18
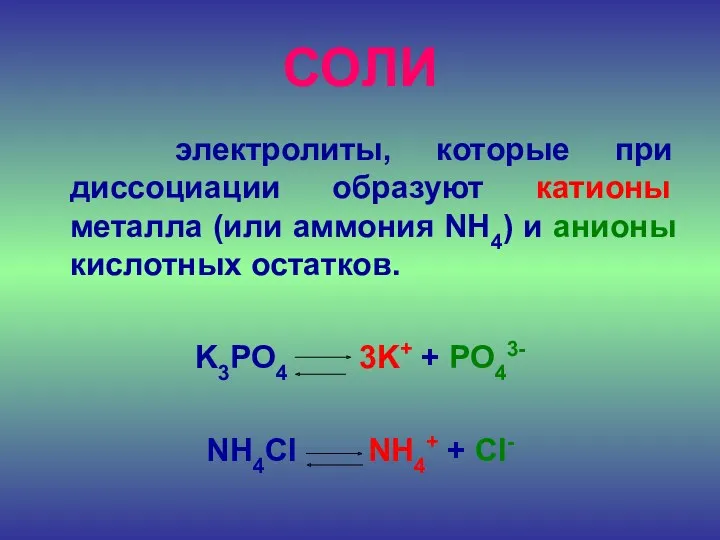
СОЛИ
электролиты, которые при диссоциации образуют катионы металла (или аммония NH4)
и анионы кислотных остатков.
K3PO4 3K+ + PO43-
NH4Cl NH4+ + Cl-

















 Химическая посуда и лабораторное оборудование
Химическая посуда и лабораторное оборудование 5511c750430548bfa1da4ba840324bb2
5511c750430548bfa1da4ba840324bb2 Взрывчатые вещества. Пероксид ацетона и пикриновая кислота
Взрывчатые вещества. Пероксид ацетона и пикриновая кислота Физические явления. Способы получения чистых химических веществ с помощью физических явлений
Физические явления. Способы получения чистых химических веществ с помощью физических явлений Основания. Состав, классификация, свойства, получение
Основания. Состав, классификация, свойства, получение Органические кислоты и основания. Лекция 6
Органические кислоты и основания. Лекция 6 Алкадиены (диены, диеновые углеводороды)
Алкадиены (диены, диеновые углеводороды) Магнезит
Магнезит Резина и её свойства . Полимеры и их использование
Резина и её свойства . Полимеры и их использование Электролиз раствора щёлочи с использованием железного анода
Электролиз раствора щёлочи с использованием железного анода Алкины. Ацетилены
Алкины. Ацетилены Дипломная работа. Тема: Получение гальванических покрытий на основе цинка
Дипломная работа. Тема: Получение гальванических покрытий на основе цинка Ионные уравнения реакций
Ионные уравнения реакций Розчини
Розчини Основы теории пространственного строения органических соединений. Конфигурации и конформации. Лекция 1
Основы теории пространственного строения органических соединений. Конфигурации и конформации. Лекция 1 Теория электролитической диссоциации (ТЭД)
Теория электролитической диссоциации (ТЭД) История развития контролируемой радикальной полимеризации. Управление ростом полимерной цепи нитроксильными радикалами
История развития контролируемой радикальной полимеризации. Управление ростом полимерной цепи нитроксильными радикалами Нефть и способы ее переработки (10 класс)
Нефть и способы ее переработки (10 класс) Кислородсодержащие органические соединения. 9 класс
Кислородсодержащие органические соединения. 9 класс Жиры. Мыла. СМС. 10 класс
Жиры. Мыла. СМС. 10 класс Алкадиены. Диеновые углеводороды
Алкадиены. Диеновые углеводороды Химическая промышленность России
Химическая промышленность России Технология промышленных газов
Технология промышленных газов Кислотные и основные свойства органических соединений
Кислотные и основные свойства органических соединений Топливный элемент: проблемы и перспективы
Топливный элемент: проблемы и перспективы Тірі ағзада жүретін процесстер – физика-химиялық интерпретация
Тірі ағзада жүретін процесстер – физика-химиялық интерпретация Hydrophilization and hydrophobization of the surface of solids with the help of SAA
Hydrophilization and hydrophobization of the surface of solids with the help of SAA Теория растворов. Растворы электролитов
Теория растворов. Растворы электролитов