Содержание
- 2. ПОНЯТИЕ. СТРУКТУРА ПЕРОКСИДА АЦЕТОНА Пероксид ацетона (перекись ацетона) — инициирующее взрывчатое вещество, впервые полученное Рихардом Вольфенштейном
- 3. ПОЛУЧЕНИЕ Димерный пероксид ацетона (диперекись ацетона, 1) получают с выходом 94 % при обработке ацетона 86
- 4. ФИЗИЧЕСКИЕ СВОЙСТВА Трипероксид ацетона легко возгоняется: при температуре 14—18 °С он теряет около 6,5 % массы
- 5. ИСПОЛЬЗОВАНИЕ В КАЧЕСТВЕ ВЗРЫВЧАТОГО ВЕЩЕСТВА В военных целях пероксид ацетона не используется из-за высокой летучести и
- 6. ОБНАРУЖЕНИЕ Трипероксид и дипероксид ацетона можно обнаружить или проанализировать методом тонкослойной хроматографии на силикагеле (элюент: толуол,
- 7. 1- пероксид ацетона отфильтрованный и высушенный 2- пероксид ацетона в жидком состоянии не отфильтрованный
- 8. ПИКРИНОВАЯ КИСЛОТА(ТРИНИТРОФЕНОЛ)
- 9. ПОНЯТИЕ ТРИНИТРОФЕНОЛА 2,4,6-Тринитрофенол (пикриновая кислота) — химическое соединение C6H2(NO2)3OH, нитропроизводное фенола. Молекулярная масса 229,11 а. е.
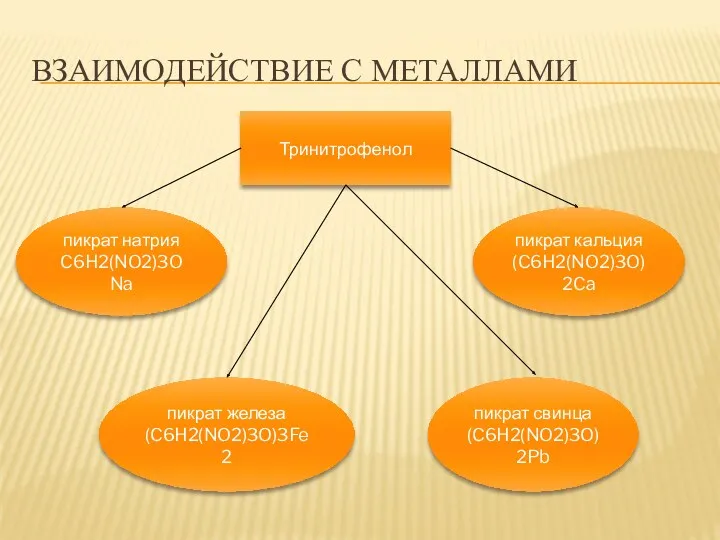
- 10. ВЗАИМОДЕЙСТВИЕ С МЕТАЛЛАМИ Тринитрофенол пикрат натрия C6H2(NO2)3ONa пикрат кальция (C6H2(NO2)3O)2Ca пикрат железа (C6H2(NO2)3O)3Fe2 пикрат свинца (C6H2(NO2)3O)2Pb
- 11. ХИМИЧЕСКИЕ СВОЙСТВА
- 12. ВЗРЫВЧАТЫЕ СВОЙСТВА Продукты взрыва в замкнутой бомбе: 71,05 % CO, 3,42 % CO2, 0,34 % O2,
- 13. Детонирует от капсюля-детонатора. Восприимчивость снижается с возрастанием плотности прессованного и ещё ниже у плавленого тринитрофенола: при
- 14. ПРИМЕНЕНИЕ И ВОЗДЕЙСТВИЕ НА ЧЕЛОВЕКА Применение: Снаряжение артиллерийских снарядов Промежуточный продукт в производстве красителей Катализатор реакций
- 16. Скачать презентацию












 Различные теории кислот и оснований
Различные теории кислот и оснований Электролитическая диссоциация. Положительно-заряженный электрод
Электролитическая диссоциация. Положительно-заряженный электрод Методические рекомендации по изучению курса Коррозия и защита металлов
Методические рекомендации по изучению курса Коррозия и защита металлов Энергетика химических процессов. Термодинамика. (Лекция 4)
Энергетика химических процессов. Термодинамика. (Лекция 4) Тренувальні вправи. Задачі
Тренувальні вправи. Задачі Циклоалканы. Предельные углеводороды с замкнутой (циклической) углеродной цепью
Циклоалканы. Предельные углеводороды с замкнутой (циклической) углеродной цепью Карбоновые кислоты
Карбоновые кислоты Метали IV групи побічної підгрупи (Ti, Zr, Hf)
Метали IV групи побічної підгрупи (Ti, Zr, Hf) Типы химических реакций
Типы химических реакций Общая характеристика металлов главных подгрупп I-III групп ПСХЭ Д.И. Менделеева
Общая характеристика металлов главных подгрупп I-III групп ПСХЭ Д.И. Менделеева Химические и физические свойства воды
Химические и физические свойства воды Каучук туралы жалпы мәліметтер
Каучук туралы жалпы мәліметтер Чисті речовини та суміші. Основні способи розділення сумішей (7 клас)
Чисті речовини та суміші. Основні способи розділення сумішей (7 клас) Химический элемент алюминий
Химический элемент алюминий Спирты
Спирты Типы химических реакций
Типы химических реакций Электролиты и неэлектролиты. Механизм электролитической диссоциации
Электролиты и неэлектролиты. Механизм электролитической диссоциации Теория электролитической диссоциации
Теория электролитической диссоциации Бериллий, магний и щелочноземельные металлы
Бериллий, магний и щелочноземельные металлы Механизмы органических реакций
Механизмы органических реакций Мицеллярные растворы ПАВ. Солюбилизация. Микроэмульсии
Мицеллярные растворы ПАВ. Солюбилизация. Микроэмульсии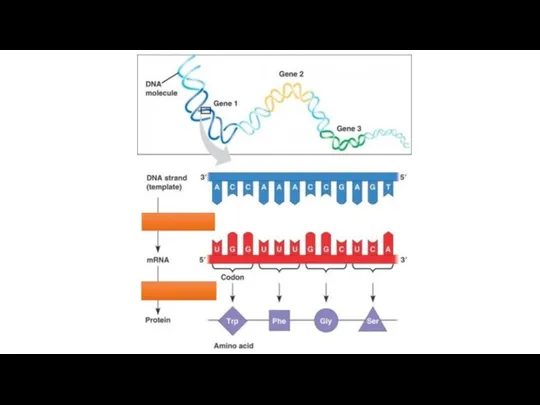 The translation and transcription
The translation and transcription Основи. Фізичні властивості основ
Основи. Фізичні властивості основ Готовимся к экзамену по химии. 9 класс
Готовимся к экзамену по химии. 9 класс Ионоселективные электроды
Ионоселективные электроды Виртуозы химического эксперимента
Виртуозы химического эксперимента Химический состав воздуха
Химический состав воздуха Типы химических соединений, номенклатура, свойства
Типы химических соединений, номенклатура, свойства