Содержание
- 2. Теория электролитической диссоциации Цели урока: сформировать представления об электролитах и неэлектролитах и их поведении в водных
- 3. тест 1. Выберите вещество с ковалентной неполярной связью: А) NaCl; б) О2; в) AlCl3; г) H2O
- 4. Электропроводность веществ. Что происходит при растворении различных веществ? Посмотрим видеофильм: ссылка 1 files.school-collection.edu.ru/dlrstore/f5aeec90-899e-14ce-df97-5627a9393b16/index.htm Попробуем ответить на
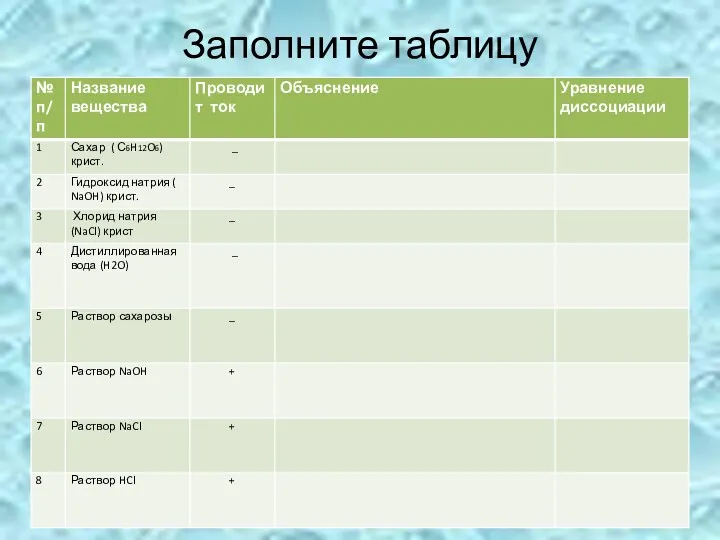
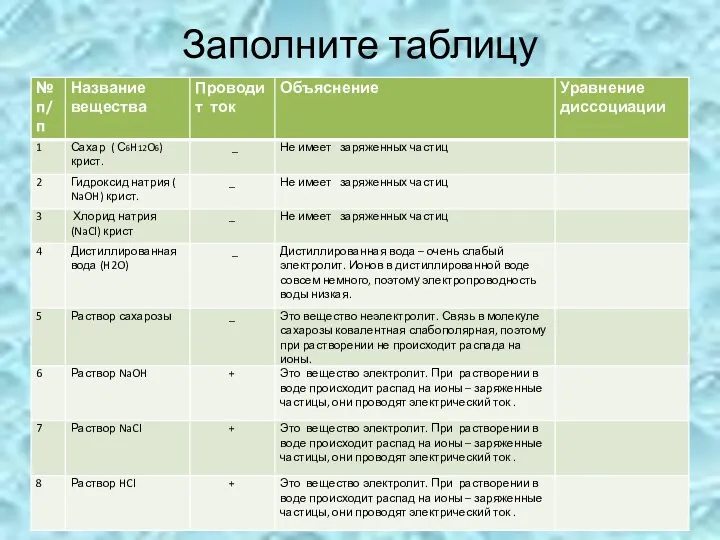
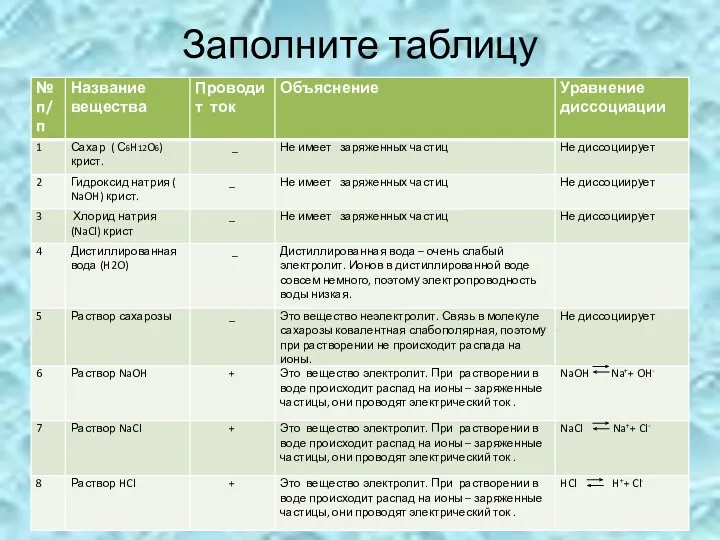
- 5. Заполните таблицу
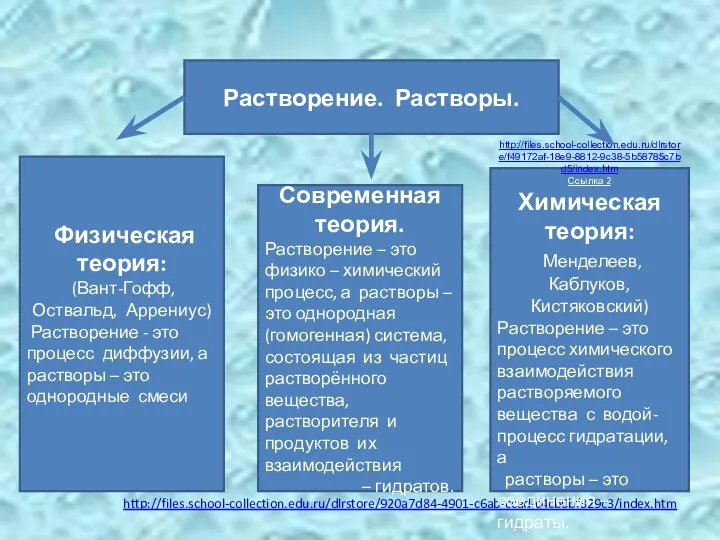
- 6. Ссылка 3 http://files.school-collection.edu.ru/dlrstore/920a7d84-4901-c6ab-ccad-c4cb0bf329c3/index.htm Растворение. Растворы. Физическая теория: (Вант-Гофф, Оствальд, Аррениус) Растворение - это процесс диффузии, а
- 7. Электропроводность расплавов Посмотрите видеофильм : «Электропроводность расплава» (ссылка 4) files.school-collection.edu.ru/dlrstore/6587f28d-c257-9420-4a83-3cb32145459d/index.htm Вывод: для того, чтобы вещества проводили
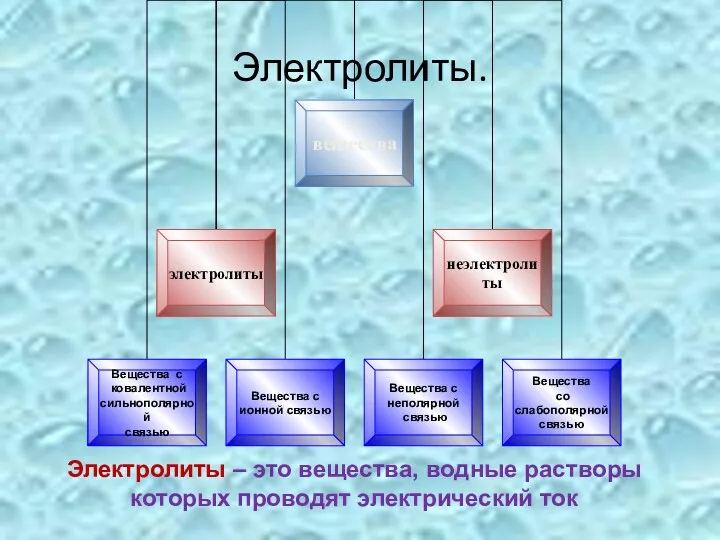
- 8. Электролиты. Электролиты – это вещества, водные растворы которых проводят электрический ток
- 9. Заполните таблицу
- 10. Основоположники ТЭД Шведский ученый, физико-химик. Автор теории электролитической диссоциации (1887 г.) В 1903 г. награжден Нобелевской
- 11. Основоположники ТЭД Русский ученый, академик. Ввел в 1889 – 1891 гг. представление о гидратации ионов. Положил
- 12. Основоположники ТЭД Кистяковский Владимир Александрович 1865-1952 гг. Русский ученый, физикохимик, академик . В 1888 г. Высказал
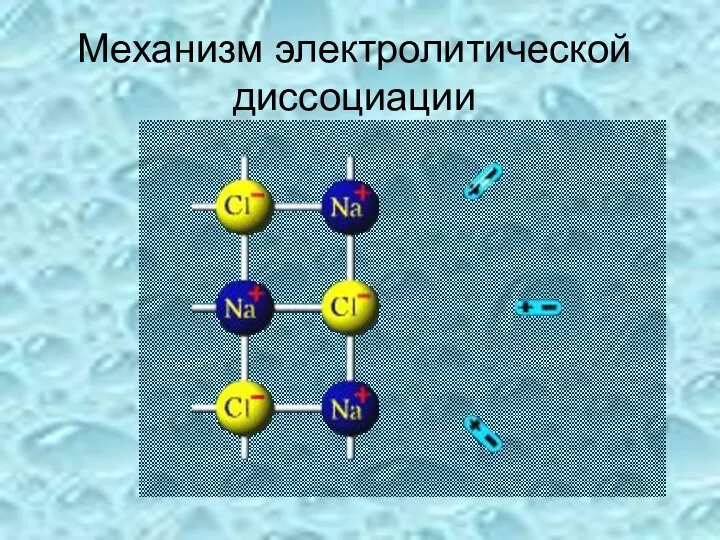
- 13. Электролитическая диссоциация Распад электролита на ионы при растворении или расплавлении, называется электролитической диссоциацией. Как происходит этот
- 14. Механизм электролитической диссоциации
- 15. Механизм электролитической диссоциации Посмотреите видеоролик «Механизм электролитической диссоциации» ссылка 8 files.school-collection.edu.ru/dlrstore/617fdbc1-8cff-11db-b606-0800200c9a66/ch08_35_03.swf
- 16. После просмотра ролика запишите следующие незаконченные предложения в тетрадь, закончите их. 1.Причиной тока в растворах являются….
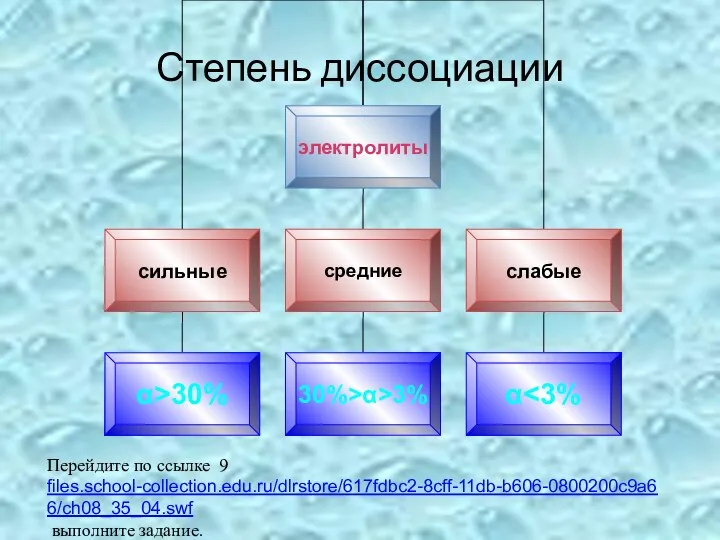
- 17. Степень диссоциации - - это отношение числа частиц, распавшихся на ионы (n), к общему числу растворённых
- 18. Степень диссоциации Перейдите по ссылке 9 files.school-collection.edu.ru/dlrstore/617fdbc2-8cff-11db-b606-0800200c9a66/ch08_35_04.swf выполните задание.
- 19. Уравнения диссоциации Уравнение электролитической диссоциации кислот: HCl ↔ H+ + Cl- Катион анион Многоосновные кислоты диссоциируют
- 20. Уравнения диссоциации Уравнение диссоциации оснований: NaOH ↔ Na+ + OH- Катион анион Ba(OH)2 ↔ Ba2+ +
- 21. Уравнения диссоциации Соли: K2CO3 ↔ 2K+ + CO32- Катионы анион Al2(SO4)3 ↔ 2Al3+ + 3SO42- Катионы
- 22. Заполните таблицу
- 23. Уравнения диссоциации Перейдите по ссылке 10 и выполните задания filesfiles.files.schoolfiles.school-files.school-collection.edu.ru/dlrstore/617fdbc4-8cff-11db-b606-0800200c9a66/ch08_36_01.swf
- 24. вывод. 1. Кислоты – электролиты, которые при диссоциации образуют только один вид катионов – катионы водорода
- 26. Скачать презентацию
















 Карбоновые кислоты
Карбоновые кислоты Сульфиды. Занятие 7
Сульфиды. Занятие 7 Свойства смесей ПАВ
Свойства смесей ПАВ Кислотно-основні рівноваги в біосистемах. Колігативні властивості біологічних рідин
Кислотно-основні рівноваги в біосистемах. Колігативні властивості біологічних рідин Игра по химии В рамках периодической таблицы
Игра по химии В рамках периодической таблицы Классификация химических элементов. Составитель. 8 класс
Классификация химических элементов. Составитель. 8 класс Кислотно-основное титрование в неводных средах
Кислотно-основное титрование в неводных средах Химический состав нефтей. Ненасыщенные углеводороды. Алкены и алкадиены
Химический состав нефтей. Ненасыщенные углеводороды. Алкены и алкадиены Гальванический элемент Даниэля-Якоби. Потенцометрия. Стеклянный электрод
Гальванический элемент Даниэля-Якоби. Потенцометрия. Стеклянный электрод Типичные реакции органических соединений
Типичные реакции органических соединений Типы химических реакций
Типы химических реакций Лужні метали
Лужні метали Галогенопроизводные углеводородов
Галогенопроизводные углеводородов Методы исследования взаимодействий с участием белков (Co-IP, equilibrium microdialysis, ITC, MST, SPR, BLI, QСM)
Методы исследования взаимодействий с участием белков (Co-IP, equilibrium microdialysis, ITC, MST, SPR, BLI, QСM) Магматические формации
Магматические формации Сущность процесса электролитической диссоциации
Сущность процесса электролитической диссоциации Основные понятия химии. Законы стехиометрии
Основные понятия химии. Законы стехиометрии Азотистая кислота
Азотистая кислота Химические волокна
Химические волокна Важнейшие классы бинарных соединений – оксиды и летучие соединения
Важнейшие классы бинарных соединений – оксиды и летучие соединения Получение порошков автоклавным осаждением
Получение порошков автоклавным осаждением Углерод и его соединения
Углерод и его соединения Икаит Ca[CO3]·6 (H2O)
Икаит Ca[CO3]·6 (H2O) Чистые вещества и смеси. Растворы
Чистые вещества и смеси. Растворы Подземное хранение газа и жидкости
Подземное хранение газа и жидкости Карбоновые кислоты и их функциональные производные. Хроматографические методы исследования
Карбоновые кислоты и их функциональные производные. Хроматографические методы исследования Аминокислоты. Пептиды. Белки
Аминокислоты. Пептиды. Белки Геохимия
Геохимия