Содержание
- 2. ЦЕЛЬ УРОКА: ПОВТОРИТЬ И ОБОБЩИТЬ ЗНАНИЯ УЧАЩИХСЯ О ХИМИЧЕСКИХ ПРЕВРАЩЕНИЯХ, ПРИЗНАКАХ И ТИПАХ ХИМИЧЕСКИХ РЕАКЦИЙ. ЗАКРЕПИТЬ
- 3. Вопросы для повторения Что изучает химия? Что такое химические превращения или химические реакции? Каковы признаки химических
- 4. ГОРЕНИЕ СВЕЧИ Признак химической реакции: выделение тепла и света
- 5. Реакция между раствором хлорида кальция и раствором щелочи. Признак химической реакции: выпадение белого осадка.
- 6. Действие индикаторов на растворы кислоты, щелочи и воды. Признак химической реакции: изменение окраски индикатора.
- 7. Реакция между раствором перманганата калия и раствором хлорида хрома (II) Признак химической реакции: выпадение зеленого осадка.
- 8. Реакция между раствором хлорида железа (III) и раствором щелочи. Признак химической реакции: выпадение бурого осадка.
- 9. ГОРЕНИЕ СТАЛЬНОЙ ПРОВОЛОКИ В КИСЛОРОДЕ Признак химической реакции: выделение тепла и света
- 10. РЕАКЦИЯ МЕДИ С АЗОТНОЙ КИСЛОТОЙ Признак химической реакции: выделение бурого газа
- 11. * Условия, необходимые для осуществления химической реакции: Соприкосновение веществ Перемешивание веществ Определенная температура
- 12. * Вопросы для повторения Что такое химическое уравнение? Какие реакции называются реакциями соединения? Какие реакции называются
- 13. Типы химических реакций: Соединение Разложение Замещение Обмен
- 14. Реакция соединения. А В + Реакция соединения -это реакция, при которой из двух или нескольких простых
- 15. Реакция соединения. Cu O 2 + Реакция соединения -это реакция, при которой из двух или нескольких
- 16. Реакция разложения А В + Реакция разложения - это реакция, при которой одно сложное вещество распадается
- 17. Реакция разложения H2 O 2 + Реакция разложения - это реакция, при которой одно сложное вещество
- 18. Реакция замещения А + В С Реакция замещения -это реакция, при которой атомы простого вещества замещают
- 19. Реакция замещения Fe + H Cl Реакция замещения -это реакция, при которой атомы простого вещества замещают
- 20. Реакция обмена A В + С Д Реакция обмена - это реакция, при которой два сложных
- 21. Реакция обмена Ag NO3 + H Cl Реакция обмена - это реакция, при которой два сложных
- 22. С какими типами химических реакций мы сегодня познакомились? Соединение Разложение Замещение Обмен
- 23. Определите типы реакций
- 24. Определите типы реакций Cu + CI2 → CuCI2 2Fe + 3CI2 → 2FeCI3
- 25. Определите типы реакций видео
- 26. Определите типы реакций SiO2 + Mg → MgO + Si SiO2 + 2Mg → 2MgO +
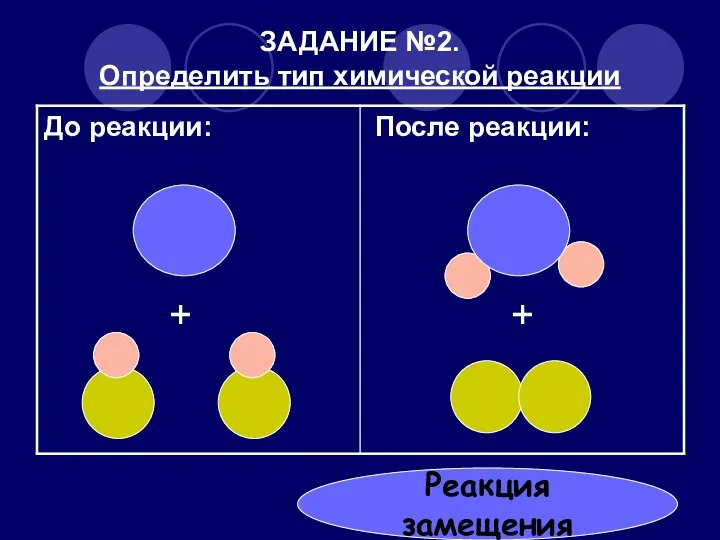
- 27. ЗАДАНИЕ №2. Определить тип химической реакции + + Реакция замещения
- 28. Игра «ТРЕТИЙ ЛИШНИЙ-1» 1. 2NaCl = 2Na + Cl2 2. CaO + CO2 = CaCO3 3.
- 29. Игра «ТРЕТИЙ ЛИШНИЙ-2» 1.2CuO + C = 2Cu + O2 2. 2NO + O2 = 2NO2
- 30. ЗАДАНИЕ Царь зовет к себе Стрельца - удалого молодца И дает ему поручение государственного значения: «Чтоб
- 31. AI + S = AI2S3 2AI + 3S = AI2S3 реакция соединения
- 32. Лабораторная работа
- 33. Техника безопасности
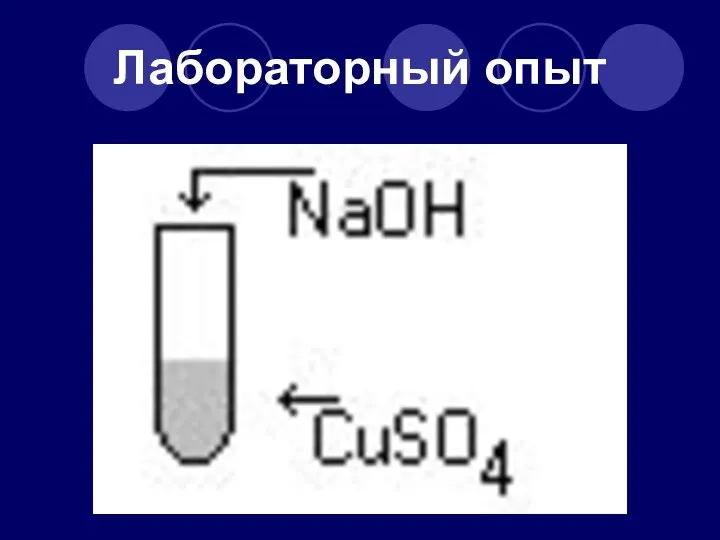
- 34. Лабораторный опыт
- 35. Напишите уравнение реакции и определите тип реакции CuSO4 + NaOH → Cu(OH)2 + Na2SO4 CuSO4 +
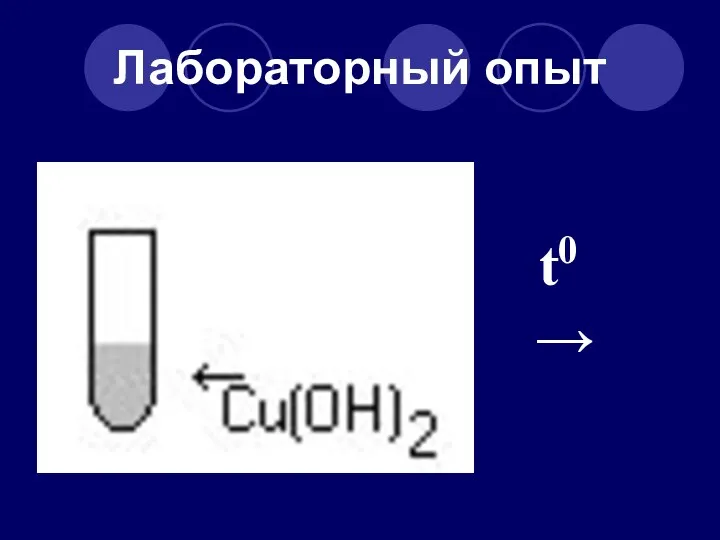
- 36. Лабораторный опыт t0 →
- 37. Напишите уравнение реакции и определите тип реакции t0 Cu(OH)2 → CuO + H2O Тип реакции –
- 38. Проверочная работа
- 39. Задание № 1 Расставьте коэффициенты и определите тип реакции в следующих уравнениях реакций:
- 40. 1 вариант Расставьте коэффициенты и определите тип реакции в следующих уравнениях реакций: А) Cu + O2
- 41. 2 вариант Расставьте коэффициенты и определите тип реакции в следующих уравнениях реакций: А) Ва + O2
- 42. 1 вариант 3. Выберите на ваш взгляд, правильный ответ. В реакциях обмена могут образоваться: а) несколько
- 43. 2 вариант 3. Выберите на ваш взгляд, правильный ответ. В реакции замещения могут вступать: а) одно
- 45. Скачать презентацию







































 Чисті речовини і суміші
Чисті речовини і суміші Oxygen, O2
Oxygen, O2 Сандық есептер (металдар мен оның қосылыстарындағы генетикалық байланысты көрсететін)
Сандық есептер (металдар мен оның қосылыстарындағы генетикалық байланысты көрсететін) В мире криссталлов
В мире криссталлов Д. И. Менделеев человек - загадка
Д. И. Менделеев человек - загадка Классификация органических соединений
Классификация органических соединений Классификация дисперсных систем
Классификация дисперсных систем Ароматические азотсодержащие соединения
Ароматические азотсодержащие соединения Железо и его соединения
Железо и его соединения Аминокислоты, их строение, изомерия, свойства, применение
Аминокислоты, их строение, изомерия, свойства, применение Галогены
Галогены Природные источники углеводородов
Природные источники углеводородов Виды химической связи
Виды химической связи Методы окислительно-восстановительного титрования (Редоксиметрия)
Методы окислительно-восстановительного титрования (Редоксиметрия) Закон сохранения массы веществ
Закон сохранения массы веществ Электрофизические свойства GaAs, зонная структура, полупроводящий и полуизолирующий GaAs, способы создания p-n перехода
Электрофизические свойства GaAs, зонная структура, полупроводящий и полуизолирующий GaAs, способы создания p-n перехода Электрохимическая защита
Электрохимическая защита Соединения кремния
Соединения кремния Катионная полимеризация (Лекция 6)
Катионная полимеризация (Лекция 6) Алкалоидтар. Алкалоидтар туралы түсінік. Жіктелуі
Алкалоидтар. Алкалоидтар туралы түсінік. Жіктелуі Алкадиены
Алкадиены Геометрическая кристаллография
Геометрическая кристаллография Закономерности управления каталитическими процессами
Закономерности управления каталитическими процессами Бензин. Физико-химические свойства бензина
Бензин. Физико-химические свойства бензина Ионные уравнения
Ионные уравнения Йод в нашей жизни
Йод в нашей жизни Кислородные соединения серы. Серная кислота
Кислородные соединения серы. Серная кислота Понятие биогенности химических элементов
Понятие биогенности химических элементов