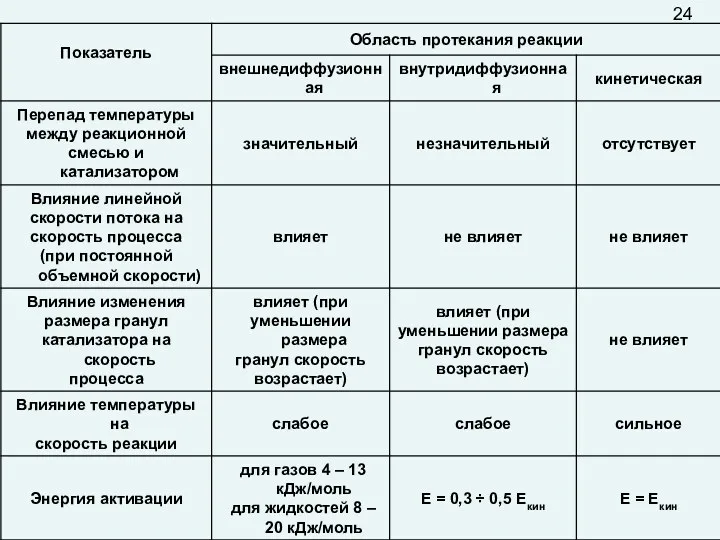
Для интенсификации процесса, протекающего во внешнедиффузионной области, используются такие инструменты управления,
которые увеличивают скорость массопередачи в пограничном слое: повышение линейной скорости подачи реагентов, увеличение удельной поверхности контакта фаз (например, использование движущегося и «кипящего» слоя катализатора и др.).
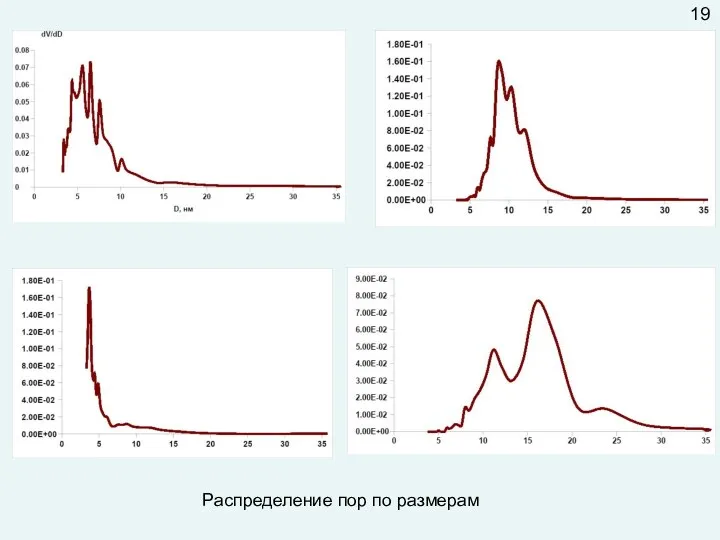
В случае внутридиффузионной области лимитирующей является стадия движения молекул внутри пор. Это движение зависит от размера пор. В широких порах перенос вещества описывается законами молекулярной диффузии (молекулы чаще сталкиваются между собой, чем со стенкой). В узких порах увеличивается вероятность ударов молекул о стенки канала, скорость движения зависит от диаметра этого канала, то есть описывается другими законами.
Во внутридиффузионной области химическая реакция и диффузия протекают одновременно, поэтому эту область можно назвать переходной между кинетической и внешнедиффузионной; на скорость процесса оказывают влияние как кинетические, так и диффузионные факторы.
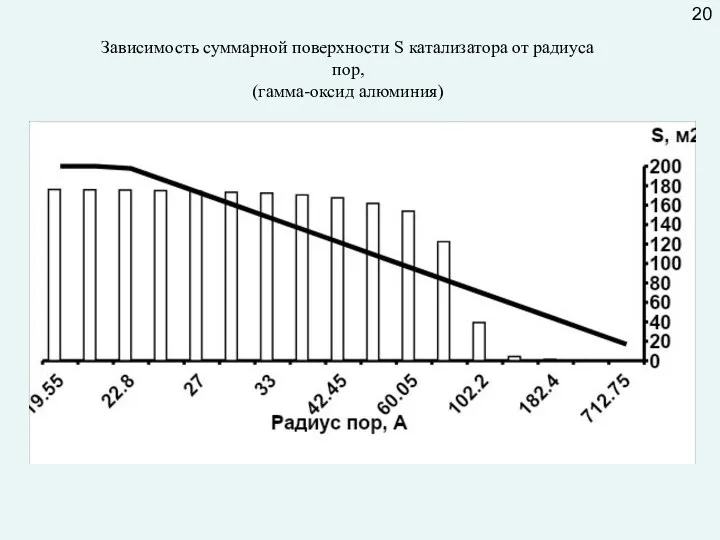
Внутридиффузионное торможение можно «снять» путем увеличения диаметра пор и (или) уменьшения их длины (уменьшая размер гранулы катализатора или используя гранулы с отверстиями).
Кинетическая область является наиболее благоприятной для ведения гетерогенно-каталитического процесса: работает вся поверхность катализатора, выделяющееся тепло легко отводится, достигается высокая селективность процесса. Скорость процесса равна скорости химической реакции.
Для ускорения процесса, протекающего в кинетической области, используют кинетические факторы.
25



















 Хімічні формули речовин
Хімічні формули речовин Водород
Водород Химиялық қауіптілер. Нитраттар
Химиялық қауіптілер. Нитраттар Кислоты в свете теории электролитической диссоциации (ТЭД)
Кислоты в свете теории электролитической диссоциации (ТЭД) Кристаллическое строение и свойства металлов
Кристаллическое строение и свойства металлов Материаловедение промышленного производства. Особенности строения твердых тел
Материаловедение промышленного производства. Особенности строения твердых тел Неметаллы: общая характеристика. 9 класс
Неметаллы: общая характеристика. 9 класс Понятия про синтетические лекарственные средства
Понятия про синтетические лекарственные средства Основи. Властивості, застосування гідроксидів Натрію і Калію
Основи. Властивості, застосування гідроксидів Натрію і Калію Акцепторы катионов и анионов. Краун-эфиры и близкие структурные аналоги: поданды, лариатэфиры. Супрамолекулярная фотоника
Акцепторы катионов и анионов. Краун-эфиры и близкие структурные аналоги: поданды, лариатэфиры. Супрамолекулярная фотоника Химия в Великую Отечественную войну
Химия в Великую Отечественную войну Массовая доля вещества в растворе
Массовая доля вещества в растворе Строение атома. Периодический закон и периодическая система элементов
Строение атома. Периодический закон и периодическая система элементов Современные химические технологии
Современные химические технологии Каталитический риформинг
Каталитический риформинг Получение, собирание, распознавание газов. (Практическая работа 2)
Получение, собирание, распознавание газов. (Практическая работа 2) Углеводороды. Предельные нециклические (ациклические) углеводороды. Алканы
Углеводороды. Предельные нециклические (ациклические) углеводороды. Алканы Простые вещества
Простые вещества Незвичайна вода
Незвичайна вода Фазовое равновесие
Фазовое равновесие Химия в повседневной жизни человека
Химия в повседневной жизни человека Химическая очистка сточных вод. Окисление и восстановление
Химическая очистка сточных вод. Окисление и восстановление Растворы: состав и их коллигативные свойства
Растворы: состав и их коллигативные свойства Щелочные и щелочноземельные металлы
Щелочные и щелочноземельные металлы Относительная молекулярная масса вещества. Задачи
Относительная молекулярная масса вещества. Задачи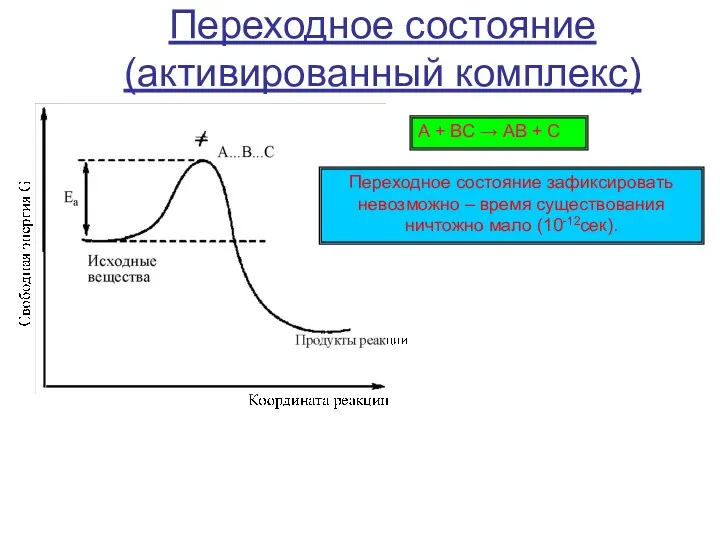 Химические свойства карбокатионов
Химические свойства карбокатионов Тіршілік процесіне қатысатын гетерофункционалды қосылыстар
Тіршілік процесіне қатысатын гетерофункционалды қосылыстар Скорость химических реакций
Скорость химических реакций